聲明:因水平有限,錯誤不可避免,或有些信息非最及時,歡迎留言指出。本文僅作醫(yī)療健康相關(guān)藥物介紹,非治療方案推薦(若涉及);本文不構(gòu)成任何投資建議。
FDA手握“生殺大權(quán)”,不僅影響著大藥企,還決定著眾多Biotech的生死,也牽動著國內(nèi)藥企們的心。據(jù)不完全統(tǒng)計,2022年有18款藥物被拒,涉及治療新冠藥物、罕見病、抗體藥、兒童生長激素、阿爾茨海默癥、放射免疫療法等各個方面,看看原因何在?
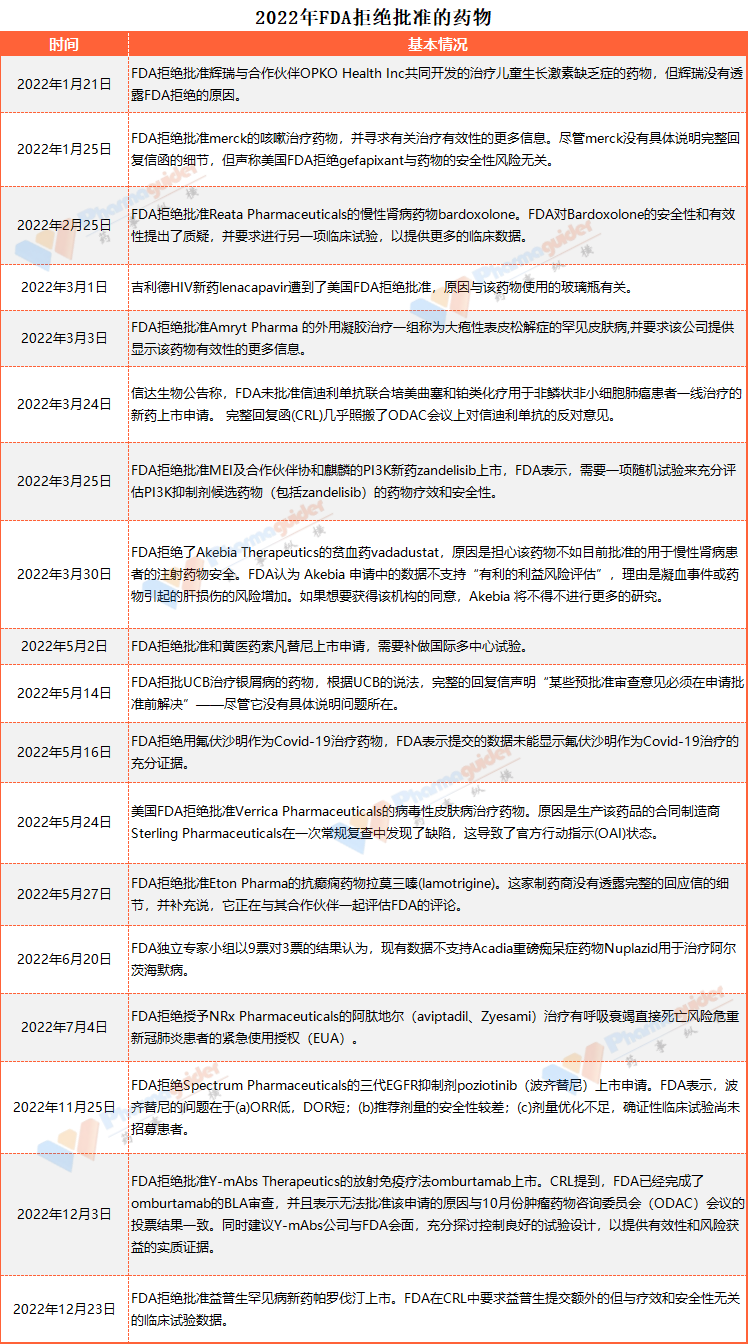
2022年1月21日,輝瑞表示,F(xiàn)DA拒絕批準(zhǔn)其與合作伙伴OPKO Health Inc (OPK.O)?共同開發(fā)的治療兒童生長激素缺乏癥的藥物,但輝瑞沒有透露FDA拒絕的原因。Somatrogon是一種實驗性的、每周一次的長效重組人生長激素,用于治療兒科患者的生長激素缺乏癥?(GHD)。2014年,輝瑞和OPKO就用于治療GHD的somatrogon的開發(fā)和商業(yè)化達成了一項全球協(xié)議。根據(jù)協(xié)議,OPKO負責(zé)開展臨床項目,輝瑞負責(zé)GHD產(chǎn)品的注冊和商業(yè)化。
2022年1月25日,F(xiàn)DA拒絕批準(zhǔn)merck的咳嗽治療藥物,并尋求有關(guān)治療有效性的更多信息。盡管merck沒有具體說明完整回復(fù)信函的細節(jié),但聲稱美國FDA拒絕gefapixant與藥物的安全性風(fēng)險無關(guān)。merck研究公司高級副總裁兼全球臨床開發(fā)負責(zé)人、首席醫(yī)療官Roy Baynes博士表示,merck將仍然致力于為難治性或不明原因慢性咳嗽患者推進gefapixant的研發(fā)工作,并將與美國FDA合作解決該機構(gòu)的反饋意見,“merck認(rèn)為,幫助患者控制慢性咳嗽的臨床需求目前尚未得到滿足,因為在美國市場沒有專門針對這種情況的治療方案。”
2022年2月份,F(xiàn)DA拒絕批準(zhǔn)Reata Pharmaceuticals的慢性腎病藥物bardoxolone。FDA對Bardoxolone的安全性和有效性提出了質(zhì)疑,并要求進行另一項臨床試驗,以提供更多的臨床數(shù)據(jù)。
2022年3月份,有5款藥物被FDA拒絕批準(zhǔn)。其中包括信達生物的PD-1。FDA在回覆函中建議信迪例單抗聯(lián)合化療與一線轉(zhuǎn)移性NSCLC的標(biāo)準(zhǔn)療法進行以總生存期為終點、多區(qū)域的非劣效性臨床試驗。
其次還有:吉利德HIV新藥lenacapavir遭到了美國FDA拒絕批準(zhǔn),原因與該藥物使用的玻璃瓶有關(guān);FDA拒絕批準(zhǔn)Amryt Pharma的外用凝膠治療一組稱為大皰性表皮松解癥的罕見皮膚病,并要求該公司提供顯示該藥物有效性的更多信息;FDA拒絕批準(zhǔn)MEI及合作伙伴Kyowa Kirin(協(xié)和麒麟)的PI3K新藥zandelisib上市,F(xiàn)DA表示,需要一項隨機試驗來充分評估PI3K抑制劑候選藥物(包括zandelisib)的藥物療效和安全性;FDA拒絕了Akebia Therapeutics的貧血藥vadadustat,原因是擔(dān)心該藥物不如目前批準(zhǔn)的用于慢性腎病患者的注射藥物安全。FDA認(rèn)為Akebia申請中的數(shù)據(jù)不支持“有利的利益風(fēng)險評估”,理由是凝血事件或藥物引起的肝損傷的風(fēng)險增加。如果想要獲得該機構(gòu)的同意,Akebia將不得不進行更多的研究。
2022年5月份有5款藥物遭到FDA拒絕批準(zhǔn)。其中包括和黃醫(yī)藥索凡替尼、UCB治療銀屑病的藥物、用氟伏沙明作為Covid-19治療藥物、Verrica Pharmaceuticals的病毒性皮膚病治療藥物以及Eton Pharma的抗癲癇藥物。
2022年5月2日,和黃醫(yī)藥宣布,美國FDA已就索凡替尼用于治療胰腺和非胰腺神經(jīng)內(nèi)分泌瘤的新藥上市申請發(fā)出完整回復(fù)函。FDA認(rèn)為當(dāng)前基于兩項成功的中國III期研究以及一項美國橋接研究的數(shù)據(jù)包尚不足以支持藥品現(xiàn)時于美國獲批。該完整回復(fù)函中表明,需要納入更多代表美國患者人群的國際多中心臨床試驗(MRCT)來支持美國獲批。
五月份:5款藥物遭到FDA拒絕批準(zhǔn)
2022年6月20日,F(xiàn)DA獨立專家小組以9票對3票的結(jié)果認(rèn)為,現(xiàn)有數(shù)據(jù)不支持Acadia重磅癡呆癥藥物Nuplazid用于治療阿爾茨海默病。

Nuplazid是一種選擇性5-羥色胺反向激動劑和拮抗劑,于2016年獲得批準(zhǔn),成為第一種被批準(zhǔn)用于治療與帕金森病精神病相關(guān)的幻覺和妄想的藥物。大多數(shù)FDA顧問表示Nuplazid在阿爾茨海默氏癥中的2期Study-019 試驗沒有得到很好的控制。他們指出,治療組和安慰劑組中超過一半的患者與試驗方案有偏差。
2022年8月4日,F(xiàn)DA已向Acadia Pharmaceuticals發(fā)出完整的回復(fù)函(CRL),F(xiàn)DA對提交材料中包含的數(shù)據(jù)的局限性表示擔(dān)憂,并建議Acadia使用pimavanserin(Nuplazid)進行額外的AD精神病試驗。

2022年7月4日,NRx Pharmaceuticals公司宣布,美國FDA拒絕授予阿肽地爾(aviptadil、Zyesami)治療有呼吸衰竭直接死亡風(fēng)險危重新冠肺炎患者的緊急使用授權(quán)(EUA)。
2022年11月25日,Spectrum Pharmaceuticals宣布,已收到FDA就三代EGFR抑制劑poziotinib(波齊替尼)的新藥申請(NDA)發(fā)出的完整回復(fù)函(CRL),用于先前接受過治療的攜帶HER2外顯子20插入突變的局部晚期或轉(zhuǎn)移性非小細胞肺癌(NSCLC)患者。Spectrum表示,此次被拒是意料之中的事情,鑒于此結(jié)果,公司將降低波齊替尼項目的優(yōu)先級并計劃將該項目的研發(fā)人員裁減75%。
2022年9月,F(xiàn)DA召開腫瘤藥物咨詢委員會會議討論了波齊替尼的療效。會議上,專家組以9:4的投票結(jié)果認(rèn)為波齊替尼的治療風(fēng)險大于益處。FDA表示,波齊替尼的問題在于(1)ORR低,DOR短;(2)推薦劑量的安全性較差;(3)劑量優(yōu)化不足,確證性臨床試驗尚未招募患者。受到此消息影響,Spectrum當(dāng)日股價大跌近40%。
2022年12月3日,F(xiàn)DA拒絕批準(zhǔn)放射免疫療法omburtamab上市。據(jù)Y-mAbs Therapeutics官網(wǎng)消息,F(xiàn)DA已經(jīng)就其放射免疫療法omburtamab治療中樞神經(jīng)系統(tǒng)/神經(jīng)母細胞瘤的軟腦膜轉(zhuǎn)移生物制品上市申請(BLA)發(fā)布了完全回復(fù)信(complete response letter,CRL)?。CRL提到,F(xiàn)DA已經(jīng)完成了omburtamab的BLA審查,并且表示無法批準(zhǔn)該申請的原因與10月份腫瘤藥物咨詢委員會(ODAC)會議的投票結(jié)果一致。同時建議Y-mAbs公司與FDA會面,充分探討控制良好的試驗設(shè)計,以提供有效性和風(fēng)險獲益的實質(zhì)證據(jù)。Y-mAbs公司董事長兼臨時CEO ThomasGad表示,收到FDA的CRL既失望,也并不感到驚訝,接下來將會進行研發(fā)重心調(diào)整,聚焦Danyelza(那昔妥單抗)更多適應(yīng)癥開發(fā)。?此前召開的ODAC會議,審評專家以16-0的投票結(jié)果表示,尚未有足夠證據(jù)表明omburtamab能改善總體生存率。
2022年12月23日,F(xiàn)DA拒絕批準(zhǔn)益普生罕見病新藥帕羅伐汀上市。
益普生宣布收到FDA就帕羅伐汀(palovarotene)用于治療進行性肌肉骨化癥(FOP)的新藥申請(NDA)發(fā)出的完整回復(fù)函(CRL)。FDA在CRL中要求益普生提交額外的但與療效和安全性無關(guān)的臨床試驗數(shù)據(jù)。對此,益普生表示將在2023年第一季度做出行動。
2022年被FDA拒絕的18款藥物中有2款涉及國內(nèi)藥企。作為出海的探路者,這兩家藥企給我們國內(nèi)藥企提供了重要的經(jīng)驗,雖敗猶榮,國內(nèi)新藥出海,“國際多中心臨床研究”成為關(guān)鍵詞。從18種被拒原因來看,主要涉及藥物療效和安全性。
編輯:小果果,轉(zhuǎn)載請注明出處:http://www.448371.com/zixun/hydt/24265.html
免責(zé)聲明:本站所轉(zhuǎn)載文章來源于其他平臺,主要目的在于分享行業(yè)相關(guān)知識,傳遞當(dāng)前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請及時告知,我們會在24小時內(nèi)刪除相關(guān)信息。
說明:本站所發(fā)布的案例均摘錄于文獻,僅用于科普干細胞與再生醫(yī)學(xué)相關(guān)知識,不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃