?
?
● ? ?● ? ? ●
From:Exosomes as novel bio-carriersfor gene and drug delivery
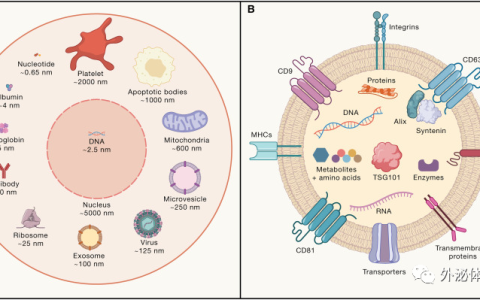
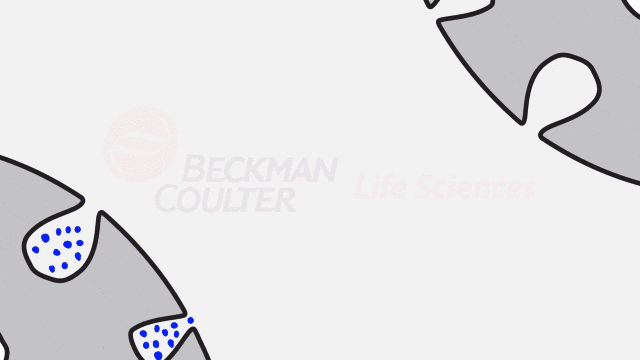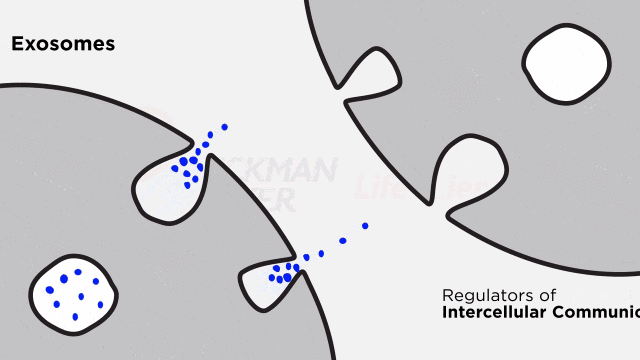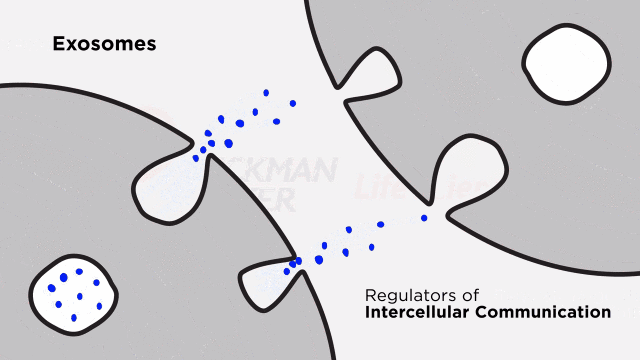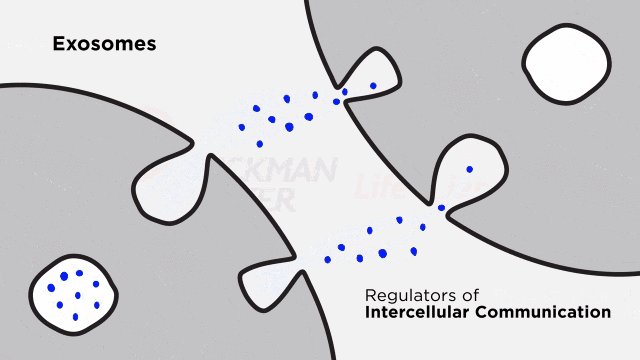
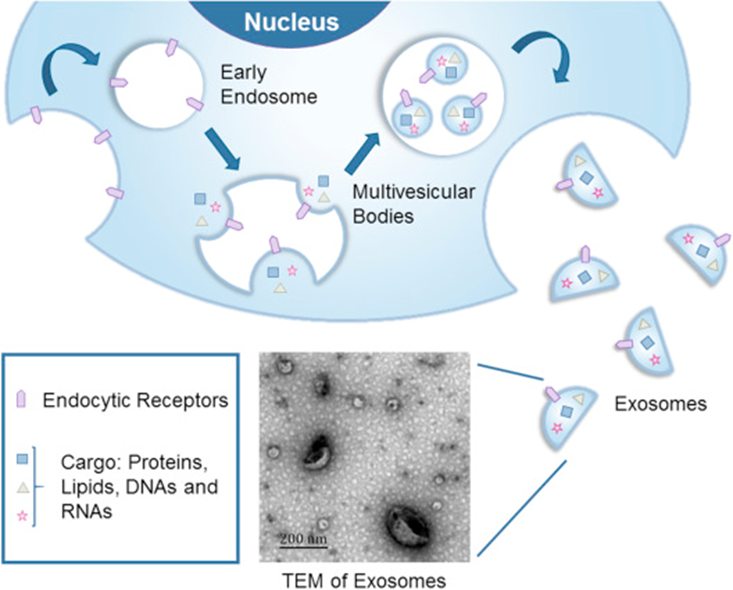
外泌體是磷脂雙層囊泡,可以由大多數的細胞(包括B細胞、T細胞、DC細胞、巨噬細胞、神經元、膠質細胞、大多數腫瘤細胞和干細胞等)產生。外泌體的粒徑在40~120nm之間。作為胞外小泡的一種,當多泡體與質膜融合時,外泌體被分泌到細胞外(圖2)。最近,越來越多的證據表明,在生物體內遺傳物質轉移的自然途徑中,外泌體可以在細胞之間傳遞豐富的物質。外泌體輸送到受體細胞是介導細胞行為變化的關鍵步驟。此外,它們在細胞間通訊中也發揮著重要作用。由于這些特性,外泌體有望被用作藥物和基因遞送的載體。
From:Exosomes as novel bio-carriersfor gene and drug delivery
–01–
外泌體:細胞間的轉運體
?
–02–
外泌體的藥物遞送優勢
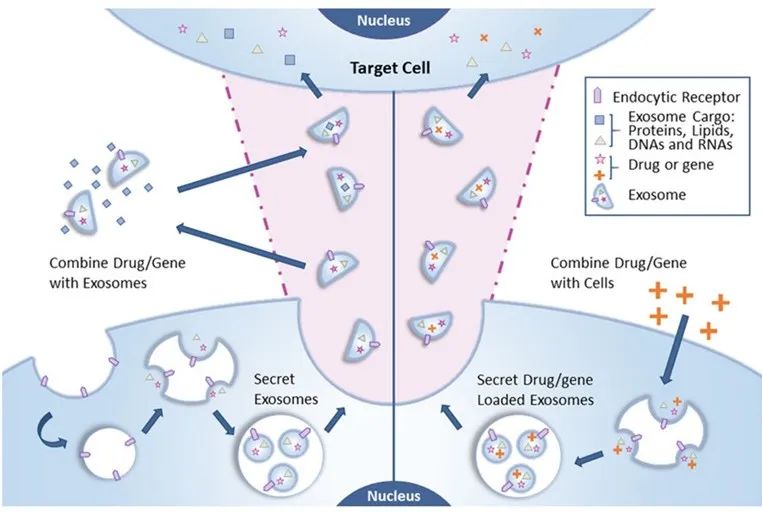
實現藥物或基因的傳遞,重要的是載體類型。外泌體載體綜合了細胞藥物遞送和納米技術的優勢。與細胞療法相比,外泌體更容易儲存,并且可以降低安全風險。可以從患者體液或細胞培養物中分離出外泌體,經修飾后轉移回患者體內。
?
世界第一個外泌體 I 期臨床試驗表明了,大規模外泌體生產的可行性和外泌體給藥的安全性。此外,運輸功能性siRNA和miRNA以及蛋白質的外泌體還可能對許多疾病具有治療前景。
?
外泌體的藥物遞送的幾個優點:
-
外泌體在血液中表現出更高的穩定性,能夠在生理和病理條件下在體內進行長距離傳遞。
-
外泌體具有親水性核心,適合容納可溶性藥物。
-
外泌體是納米級的,并攜帶細胞表面分子,具有克服各種生物屏障的能力,并且具有天然的靶向能力。
-
外泌體的免疫原性非常低。
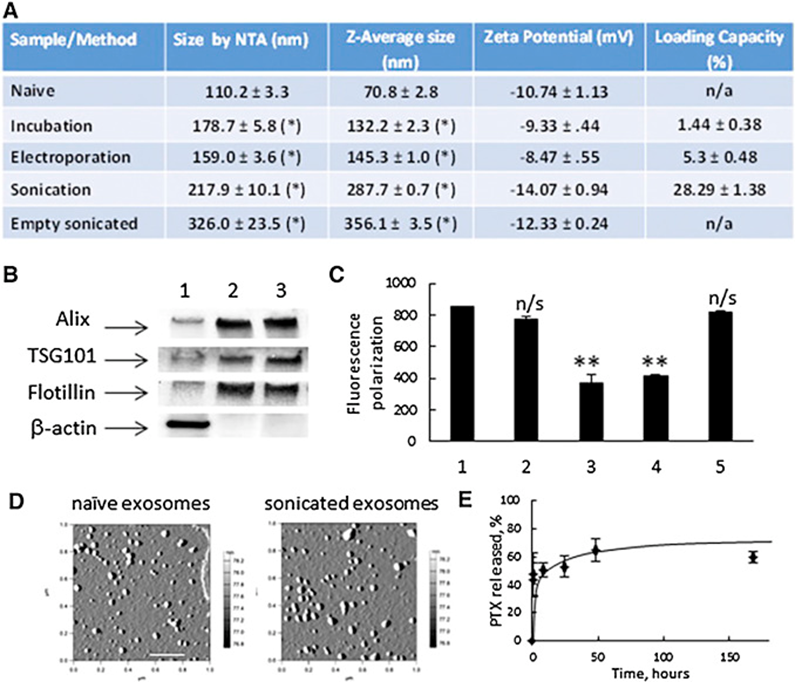
▉??孵化
將藥物與外泌體結合的最簡單方法可能是共孵育。將紫杉醇(PTX)與間充質干細胞一起孵育產生了負載PTX的外泌體,這些外泌體表現出顯著的抗腫瘤作用。
▉??電穿孔
在1000kV 電壓下,電穿孔藥物和外泌體的混合物5毫秒,成功地將藥物裝載到外泌體中。然而,這會加劇外泌體聚集的可能性。所以有必要確保外泌體均勻分散,以保證其在體內的功能,并增強其在儲存期間的穩定性。
▉??超聲
處理藥物-外泌體混合物。通過超聲處理可以有效地將藥物裝載到外泌體中。考慮到大小、Zeta電位和載藥量,超聲處理后外泌體膜的結構和含量沒有顯著變化。此外,外泌體藥物制劑在各種條件下保持了一個多月的穩定性。與其他納米顆粒相比,載藥的外泌體被大量吸收。它們還可以克服P-糖蛋白(P-gp)介導的藥物外流,從而提高耐藥腫瘤的治療效果。
From:Exosomes as novel bio-carriersfor gene and drug delivery
?
–03–
外泌體的攝取和潛在靶向能力
外泌體起源于晚期內吞室,可擴散到細胞間液中。外泌體可以通過快速融合或內吞作用運送物質。當外泌體到達特定受體細胞后,外泌體表面分子與膜受體結合(包括細胞間粘附分子,淋巴細胞功能相關抗原1和TIM1)。最后,外泌體內容物被釋放到靶細胞中。外泌體可能通過三種潛在機制被靶細胞吸收:
-
通過細胞膜的簡單融合、 -
內吞作用 -
通過特定表面配體激活靶細胞。外泌體中的一些蛋白質成分可能有助于形成保護性外殼以及穩定的囊泡結構,并可能攜帶靶向信息。
–04–
外泌體用于藥物遞送系統的挑戰
外泌體的一個關鍵問題是,如何獲得高產量純外泌體的。這主要是由于哺乳動物細胞釋放的外泌體數量相對較低。此外,外泌體的純化很麻煩。有幾種方法可以從細胞培養上清液或生物液體(如牛奶、尿液、血漿、羊水、唾液和腦脊液)中分離外泌體(見表1)。這些方法各有優缺點。

From:Exosomes as novel bio-carriersfor gene and drug delivery
為了獲得高產量的純外泌體,第一,應該是拓展外泌體來源。第二,努力將細胞和納米載體的特性結合起來。第三,能夠增強裝載各種貨物的能力和靶向能力。因此,許多研究人員致力于開發合適的方法來修飾外泌體以裝載藥物或基因。
–05–
小結和展望
外泌體作為一個新的研究熱點,由于體內分布的廣泛性和獲取的便捷性,已成為疾病診斷治療的潛在有效方式,有著光明的前景。盡管,利用外泌體作為藥物或基因遞送載體仍處于起步階段。我們相信,隨著外泌體研究工作的深入,外泌體治療可能最終藥物或基因傳遞領域有重大突破。
(1)Exosomes as novel bio-carriers for gene and drug delivery.” International journal of pharmaceuticsvol. 521,1-2 (2017): 167-175
(2)Microvesicles and exosomes: opportunities for cell-derived membranevesicles in drug delivery.” Journal of controlled release : official journal of the ControlledRelease Society vol. 161,2 (2012): 635-44. doi:10.1016/j.jconrel.2011.11.021
(3) Exosomes in stroke pathogenesis and therapy.” The Journal of clinical investigationvol. 126,4 (2016): 1190-7.?
(4) Development of exosome-encapsulated paclitaxel to overcome MDR incancer cells.” Nanomedicine : nanotechnology, biology, and medicine vol. 12,3(2016): 655-664.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/wmt/12267.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃