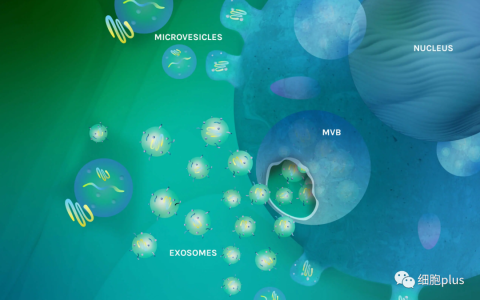
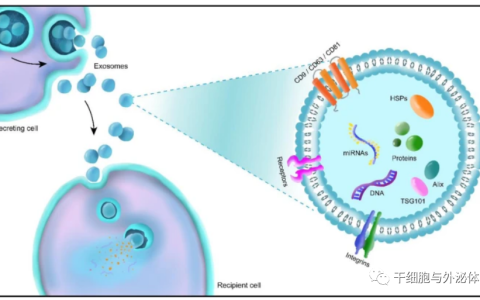
細胞外囊泡(EVs)越來越被認為是細胞間通訊的重要介質。它們在許多生理和病理過程中發揮著重要作用,并顯示出作為疾病的新型生物標志物、治療劑和藥物遞送載體的巨大潛力。然而,有趣的是,對控制EVs功能的細胞和分子機制的理解仍遠非全面,至少部分原因是分析這些小囊泡時存在技術挑戰。近日Nature Reviews Molecular Cell Biology雜志發表一篇綜述,重點闡述了我們對EV的細胞內和細胞間旅程的理解中的共識和有爭議的問題:從生物發生、細胞外空間的釋放和動力學,到與受體細胞的相互作用和攝取。該綜述指出了當前的知識差距、關鍵問題和挑戰,并就如何解決這些問題提出建議。

細胞外囊泡(EV)是細胞釋放到細胞外空間的膜包被的納米顆粒。盡管它們存在的證據已經記錄了80多年,但直到最近幾十年,它們的生成途徑、功能和潛在應用才開始出現。近年來,與EV相關的文獻數量呈指數級增長,我們對EV生物學的理解也有了不可估量的增長。現在已知它們具有許多生物學功能,并與多種病理有關。EV還具有作為生物標志物、治療劑和治療分子載體的巨大潛力。現在有廣泛的共識,即EV是發生在多細胞生物體中的細胞間信號網絡的一部分。然而,盡管對于通過EV進行細胞間通信的機制存在許多共識,但與任何快速發展的領域一樣,仍然存在一些挑戰和分歧領域。
該綜述概述了被廣泛認同的EV生物學方面,突出了最有爭議的領域,并提出特別需要進一步研究的領域。該綜述目的不是對文獻進行全面評估,并且通篇使用的參考文獻僅作為示例。為了為這項工作提供一個框架,作者描述了EV的“旅程”:從生物發生和從供體細胞釋放到它們在受體細胞中的吸收和使用/功能。
EV的生物發生的研究相對較多,但仍有許多細節有待闡明,特別是如何利用EV產生的不同機制來產生異質的囊泡亞群。
EV攝取的方式也得到了相對較好的探索,許多不同的途徑涉及囊泡的大量內化。目前最大的未知數是EV如何穿越供體和受體細胞之間的物理間隙的細節,以及一旦內化,EV的貨物如何以能夠發揮功能的方式傳遞利用。此外,需要強調的是,生物貨物的水平轉移不應總是被視為EV分泌的主要功能,也應考慮EV其他功能(包括受體細胞表面的信號傳導、營養支持、過時細胞材料的清除和間質液或細胞外基質的調節),但這些仍然相對缺乏研究。
我們知識上的這些差距主要是由于與EV相關的許多挑戰。該領域面臨著研究這些信使的工具和模型的不足,因為它們通常是納米級的尺寸,對EV種群的異質性知之甚少,以及每個囊泡的貨物分子拷貝數低,所有這些都給它們的分離和分析帶來了相當大的挑戰。與其他新興領域一樣,我們也面臨著關于數據的解釋、可變性和報告的健康辯論,甚至在用于描述EV的命名法和定義上也存在分歧。作者建議該領域應該更全面地了解EV的旅程,希望最終能激發我們的集體努力來實現這一目標。

EV生物發生和細胞外空間中傳播示意圖
Box 1 EV biogenesis: keyquestions and challenges
EV生物發生的關鍵問題和挑戰
1.?????在細胞外囊泡(EV)生物發生的研究中,我們如何考慮細胞的整體復雜性,包括細胞內運輸和細胞代謝的調節?
2.?????由于EV的生物發生也依賴于體內與鄰近細胞和基質的相互作用,“EV分泌組”在多大程度上取決于環境線索?
3.?????具有不同功能的不同外泌體亞群是否與多泡內體(MVE)亞群相關?
4.?????MVE的亞群轉變為分泌細胞器的過程是什么?
5.?????化學參數(例如細胞周圍的pH值、活性氧濃度和滲透壓)以及組織的物理約束(例如由于細胞密度或細胞外基質硬化引起的機械壓力)如何影響腔內囊泡的生成和分泌以及質膜萌芽?
6.?????體外描述的過程與體內相關嗎?
7.?????從更實際的角度來看,當旨在干擾EV生物發生時,我們如何考慮EV亞群生物發生的復雜性和多樣性以及EV貨物的細胞類型、培養條件和表達水平?例如,一個給定的途徑,例如神經酰胺的產生,可能會抑制一種亞型的外泌體分泌,但不會抑制其他亞型的分泌,同時影響細胞中的其他調節過程。此外,如果特定過程的抑制或損害會影響MVE的生物發生,鑒于并非所有的MVE都是分泌的,因此需要新的方法來清楚地區分給定過程在外泌體分泌過程中重要性的相關性和因果關系。
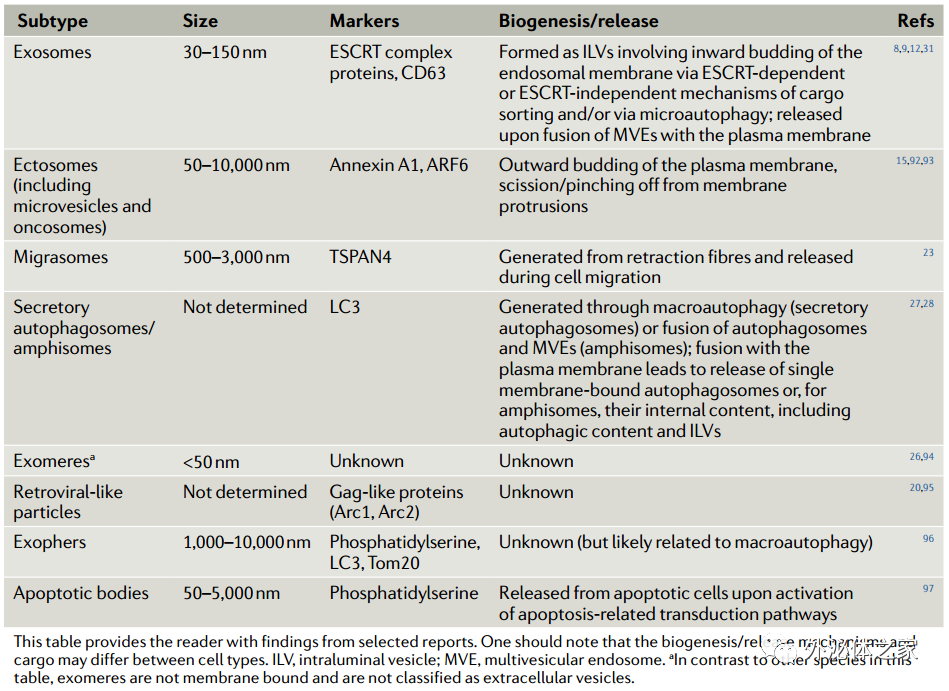
下表:迄今為止表征的細胞外囊泡/顆粒的亞型
Box 2The dynamics of EVs in extracellular space: key questions and challenges
細胞外空間中EV的動態:關鍵問題和挑戰
1.?????細胞外囊泡(EV)和細胞外基質之間的相互關系是什么?
2.?????是否所有EV都能夠穿過所有基底膜,如果不能,是否存在組織/亞群特異性?
3.?????鑒于細胞外基質在維持正常組織功能中的重要性,機械力和局部基質成分如何影響EV-細胞外基質相互作用?
4.?????細胞外基質的組成在多大程度上調節了EV的組成和功能?
5.?????哪些類型的EV與細胞外基質相互作用,特定亞群釋放到細胞外基質中是否直接取決于質膜-基質相互作用和相關的機械力?
6.?????EV是否具有允許它們在細胞外抵抗降解并避免與非靶細胞、基質成分和其他間質因子發生不良相互作用的成分/特性?
7.?????EV的生物物理特性(例如,它們的大小和可壓縮性)在穿越復雜的細胞外微環境時有多重要?
8.?????在穿過細胞外基質后,EV或至少其中的一個亞群似乎具有跨越多個生物屏障的能力。這種能力是否受到特定病理情況的影響(例如,血管通透性的增加)?
9.?????特定細胞類型是否更有效地與EV相互作用?這種相互作用在不同的EV亞群之間是否存在差異?
10.??我們對體內EV命運的大部分理解來自使用外源性EV的研究。然而,EV的分離、儲存、配制方法和標簽可能會影響它們的靶向特異性和最終命運。因此,使用外源性EV獲得的結果是否代表了內源性EV的生理命運?
11.??多種方法已被用于評估EV在體內的生物分布,包括脂質和蛋白質的熒光標記、免疫熒光、生物發光、PET、SPECT、MRI和CT成像。所有這些方法在跟蹤EV的命運方面都有局限性,需要具有大動態范圍的時間和空間分辨率的新方法來克服這些問題。
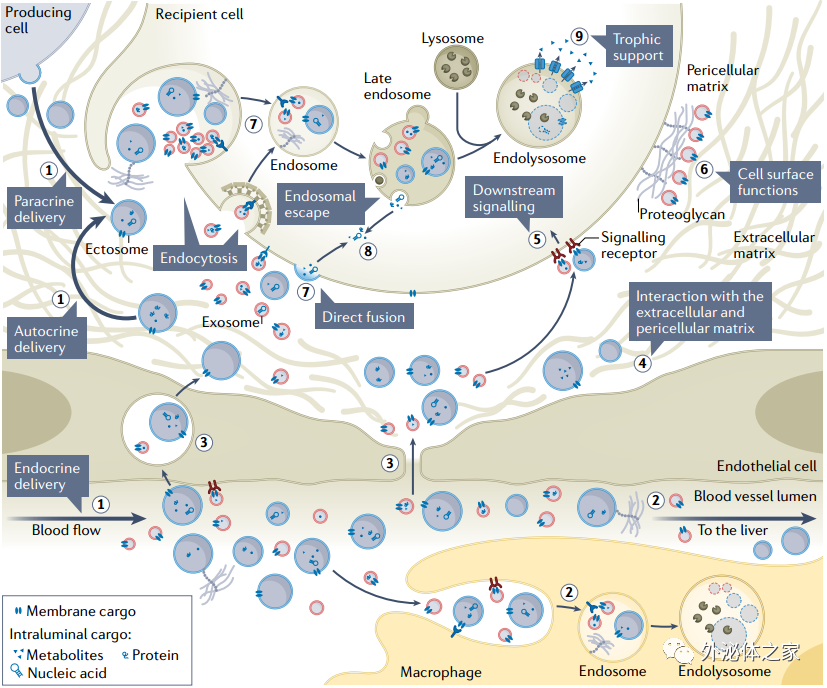
EVs在細胞外空間的動力學導致它們在受體細胞中的攝取和功能
Box 3Uptake and functional delivery of EV cargo: key questions and challenges
EV貨物的吸收和功能性遞送:關鍵問題和挑戰
1.? 哪些細胞外囊泡(EV)相關因子對于決定功能(由信號誘導和/或細胞進入定義)至關重要?
2.?????我們能否定義控制EV靶向的規則,我們能否在未來使用基于EV的藥物的轉化研究中操縱這些知識?
3.?????天然EV成分多大程度上控制的表面蛋白質的性質,以及表面蛋白質在確定與受體細胞或整個系統的相互作用方面有多重要?
4.?????我們如何克服小型EV尺寸和貨物稀缺的技術挑戰,從而對原生EV在體內的貨物功能傳遞的直接成像提出問題?
5.?????不同的EV亞群在受體細胞中的處理方式是否不同,它們是否發揮不同的細胞功能?這種異質性可以通過單獨研究EV亞群來解決,還是以協同方式合作?
6.?????我們如何提供直接證據證明觀察到的生理效應是真正由EV介導的,如果是這樣,哪些EV貨物負責?在這方面,一個被忽視的方面是EV與其他通訊方式(如細胞間接觸、納米管或細胞因子或細胞外RNA等可溶性因子)相比的相對貢獻。
7.?????當試圖剖析EV在引導來自其他分泌組成分的細胞通訊方面的相對效力時,不同的非囊泡分泌因子(如細胞外基質蛋白和細胞因子)與EV合作在決定最終和復雜細胞反應中的重要性?
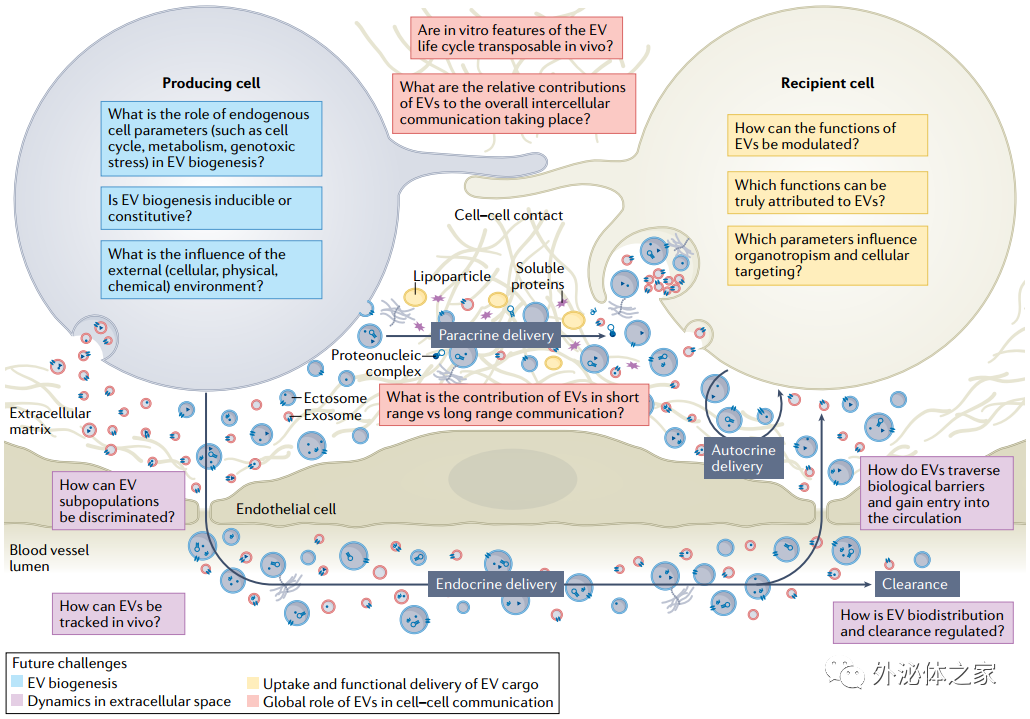
研究EV生物學的關鍵問題和挑戰
在過去的二十年里,EV領域取得了巨大的飛躍。從高質量文獻的增加和適合研究這些小信使的技術的發展中可以看出這一點。對體內EV運輸機制的了解滯后,是作者建議需要更多關注的領域。實現這一目標將需要資助機構的進一步投資以及開發更多工具和體內模型來研究EV。作者特別鼓勵來自不同學科的研究人員進行互動,包括基礎細胞生物學家、臨床醫生、技術專家以及計算機科學家,因為真正的跨學科交叉可以促進特定領域的飛躍。毫無疑問,這個令人興奮的領域正在迅速發展,這將繼續影響我們對多細胞生物如何被調控的基本理解。
參考文獻:
vanNiel G, Carter DRF, Clayton A, Lambert DW, Raposo G, Vader P. Challenges anddirections in studying cell-cell communication by extracellular vesicles. NatRev Mol Cell Biol. 2022 Mar 8. doi: 10.1038/s41580-022-00460-3.Epub ahead of print. PMID: 35260831.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/wmt/10033.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃