01
介紹
免疫療法(如細胞因子療法、免疫檢查點阻斷和CAR-T細胞療法)豐富了血液腫瘤患者的治療方法并改善了預后。隨著對NK細胞的獨特特征和特化細胞毒性的日益關注,研究重點已從 T 細胞轉移到NK細胞。
NK細胞屬于先天淋巴細胞家族,是一類細胞毒性免疫細胞,已通過其“天然”能力進行功能鑒定。人類NK細胞以 CD3-CD56+ 免疫表型為特征,可細分為兩個亞組: CD56brightCD16low/- 細胞(不太成熟的細胞群)和 CD56dimCD16bright 細胞(高細胞毒性細胞的成熟細胞群)。
臨床證據表明,同種異體 NK 細胞的過繼輸血很少引起 GVHD,此外,NK 細胞甚至可以通過靶向受體的樹突細胞來防止GVHD 。
各種方法用于基于NK細胞的免疫治療。
首先,添加細胞因子可以增強NK細胞在體內和體外的活化、增殖和持久性 。
其次,已經研究了各種抗體以通過多種機制進一步增強 NK 細胞的殺傷活性:(1) 針對特定腫瘤相關抗原 (TAA) 的單克隆抗體 (mAb) 已被批準用于治療血液系統惡性腫瘤。關于 NK 細胞介導的抗體依賴性細胞介導的細胞毒性 (ADCC) ;(2) CD16雙和三殺傷細胞接合劑(CD16 BiKEs 和 CD16 TriKEs)是一種新型抗體,可以同時結合兩種或三種不同且獨特的抗原來強烈激活 NK 細胞功能,一種是 NK 細胞激活受體 CD16,另一種是一兩個是 TAA;(3)靶向免疫檢查點或其相應配體的mAb可以恢復NK細胞的抗腫瘤功能;(4) 靶向 NK 細胞抑制性受體(例如 KIR 和 NKG2A)的 mAb 也仍在研究中。
第三,輸注NK細胞是一種有效的過繼免疫治療方法,可提高NK細胞的數量和功能。這些用于 NK 細胞療法的方法適用于 CAR-NK 細胞療法。

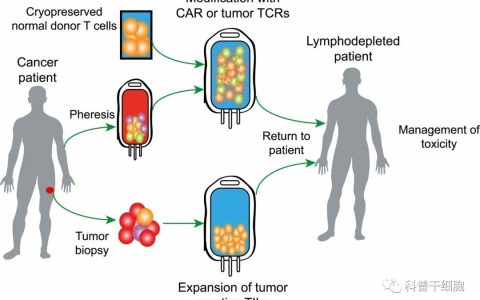
圖1 CAR-NK細胞和CAR-T細胞的來源和制造過程。
02
CAR-NK的血液腫瘤臨床試驗
基于 CAR-T 的細胞療法在 B 細胞惡性腫瘤的管理中蓬勃發展,前景廣闊。B 細胞淋巴瘤和白血病的 CAR-T 細胞療法中常用的靶抗原(例如 CD19、CD20 和 CD22)也適用于 CAR-NK 細胞。已經進行了多項臨床前和臨床試驗來測試 CAR-NK 細胞對 B 細胞惡性腫瘤的療效(表 1)。
表1 CAR-NK細胞在血液系統惡性腫瘤中的臨床試驗。

NCT03056339介紹,詳見前天和昨天的文章鏈接
CAR.19/IL-15 臍帶血來源的NK顯示出長期持久性和有效的抗腫瘤活性
FT596介紹
FT596 是一種通用的現成 CAR-iNK 細胞產品,包含 CD19、hnCD16 和 IL-15 受體,目前正在兩項臨床試驗(NCT04555811 和 NCT04245722)中進行研究。I 期多中心研究 (NCT04555811) 的目的是評估FT596與利妥昔單抗聯合用于 B 細胞淋巴瘤自體造血干細胞移植患者預防復發的安全性。
FT576介紹
抗體依賴性細胞毒性 (ADCC) 是CD38靶向mAb的關鍵作用機制;然而,自然殺傷(NK)細胞上的高 CD38 表達會導致自相殘殺,從而耗盡ADCC所需的NK細胞。除CD38外,還探索了靶向其他MM相關細胞表面蛋白。在這些抗原中,TNF 超家族成BCMA是研究最多的抗原之一,多個小組正在開發作為CAR靶點。MM的幾項臨床試驗顯示了用CAR T細胞靶向 BCMA的有希望的初步結果,但是仍有很大的機會來提高復發率和復發患者的治療。總的來說,臨床數據表明,與單獨靶向任一抗原相比,CD38和BCMA的組合靶向可能會提高臨床療效。
FT576是新開發出一種多靶點、過繼性 NK 細胞免疫療法來治療 MM。該策略具有四個工程屬性:
1) 用于直接MM靶向的抗BCMA CAR;
2) 用于增強ADCC的高親和力非裂解 CD16 (hnCD16) 與抗CD38 mAb的組合;
3) CD38缺失,可抵抗抗 CD38 mAb 誘導的 NK 細胞耗竭;和
4) IL-15/IL-15受體α融合蛋白(IL-15RF;IL-15與IL-15Rα 融合)以增強NK細胞的持久性(圖2)。

抗 BCMA CAR 由獨特的單鏈可變片段 (scFv) 靶向結構域組成,BCMA結合親和力在低納摩爾范圍內,在 BCMA 抗原密度低的疾病環境中提供高功能親和力和功效。我們的方法利用源自基因工程、克隆衍生的主多能干細胞系的NK細胞,具有抗BCMA CAR、IL-15RF、hnCD16和CD38雙等位基因敲除的均勻表達。在臨床前研究中,FT576 NK 細胞表現出 CD16、CAR 和 IL15-RF 的均勻表達,但不表達CD38 (
工程化的主多能干細胞系作為起始材料,用于一致和可重復地制造現成的 NK 細胞,這些細胞以同質的方式(稱為 FT576)包含所有描述的屬性,并且可以大規模生產以支持多劑量治療策略和按需劑量可用性。
在體外殺傷試驗中,FT576 NK 細胞完全抵抗達雷妥尤單抗誘導的殺戮,當暴露于增加濃度的達雷妥尤單抗時,沒有可檢測到的特異性細胞毒性。
相反,外周血NK細胞對達雷妥尤單抗誘導的自相殘殺敏感(達雷妥尤單抗暴露 3 小時內高達33%的細胞毒性)。與缺乏CAR表達的對照NK細胞相比,FT576 NK細胞在長期細胞毒性試驗中表現出對MM1.S MM 細胞系的增強的細胞毒性(FT576的細胞毒性為 62%,對照為 26%)。
此外,細胞持久性大于缺乏IL-15RF蛋白的NK細胞,并且FT576 NK細胞在沒有外源細胞因子支持的情況下顯示出獨特的體外擴增能力(61 倍擴增對比 IL-15RF 陰性的 4 倍擴增)。重要的是,FT576 NK細胞仍然具有ADCC能力,因為在二維細胞毒性測定中,與達雷妥尤單抗聯合增強了對MM細胞系的細胞毒性。此外,FT576介導對RPMI-8226 MM球體的直接細胞毒性,在3D球體培養模型中導致> 99%的細胞毒性。
利用遠程清除試驗,通過反復暴露于新鮮MM1S MM靶細胞的連續再刺激進行了測試,顯示出顯著的持久性和抗原介導的CAR功能擴展,在沒有外源性的情況下,通過3輪刺激,單獨或與抗體結合細胞因子支持(圖3)。

連續的遠程清除試驗表明,單獨使用FT576的 BCMA 靶向活性水平相當于針對一組 BCMA+ 靶細胞的初級 BCMA 靶向 CAR-T 細胞。利用 hnCD16,BCMA-CAR 與抗 CD38(daratumumab)、抗 SLAMF7(elotuzumab)或抗 CD19 聯合進行了測試,顯示通過各種腫瘤相關抗原 (TAA) 協同增加腫瘤靶向。通過 CAR 或 ADCC 刺激的 FT576 的多功能性同樣通過 Isoplexis 和單細胞 RNA 測序來測量。使用來自健康供體或患者的原代骨髓樣本證實了對漿細胞的特異性。

03
CAR-NK與CAR-T細胞療法的對比
CAR-T細胞和CAR-NK細胞之間的比較總結在表2中。CAR-NK細胞由于與CAR-T細胞相比具有獨特的生物學特性而具有多種優勢。在這里,我們說明了 CAR-NK 細胞在免疫治療中的優勢。

表2? CAR-T細胞與CAR-NK細胞的比較。
第一,CAR-NK細胞比CAR-T細胞具有更高的安全性。CAR-NK細胞優越的安全性主要有兩個原因。
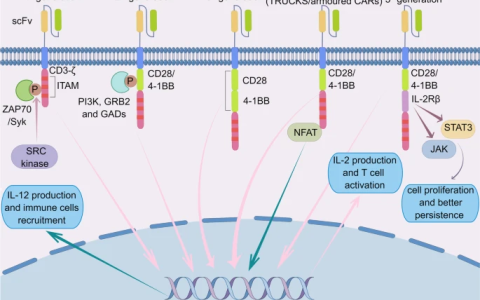
首先,CRS 和神經毒性是 CAR-T 細胞治療中觀察到的兩種常見不良反應。大量細胞因子在循環和組織中釋放,導致不同程度的癥狀,如高燒、竇性心動過速、低血壓、缺氧、心功能低下和其他器官功能障礙。CAR-T 細胞誘導的細胞因子風暴主要由促炎細胞因子(例如 TNFα、IL-1 和 IL-6)介導。而 CAR-NK 細胞分泌的一系列細胞因子(例如 IFN-γ 和 GM-CSF)與 CAR-T 細胞分泌的細胞因子不同。
其次,由于HLA 限制,來自自體或同種異體來源的CAR-T細胞可能會因HLA 限制而導致危及生命的GVHD。相反,NK 細胞被認為是介導早期GVL反應的主要效應細胞,可以通過殺死受體抗原呈遞細胞 (APC) 和細胞毒性 T 淋巴細胞來預防GVHD。因此,與CAR-T細胞產品相比,使用CAR-NK細胞可以消除臨床應用的安全性問題。
第二,CAR-NK細胞在攻擊腫瘤細胞方面可能比CAR-T細胞具有更好的功效。首先,CAR-NK細胞可以通過工程殺傷能力和內在殺傷能力識別并發揮殺傷作用(圖1)。通過CAR,效應細胞可以更有效地將其殺傷能力集中在特定抗原上。與CAR-T細胞不同,CAR-NK 細胞在靶向腫瘤抗原表達下調的情況下仍保留NK細胞的天然細胞毒性。NK細胞識別其靶細胞,然后發揮生物學作用,涉及多種機制:(1)天然細胞毒性;(2)ADCC效應;(3) TNF相關凋亡誘導配體(TRAIL);(4) FAS/FASL 。值得注意的是,NK 細胞通過各種激活和抑制受體保持動態平衡和復雜的相互作用。NK細胞被激活后,NK細胞會釋放細胞毒性顆粒(如顆粒酶和穿孔素);這些強大的武器促進了靶細胞的凋亡。其次,除了與 CAR-T 細胞共享的共刺激結構域(例如CD28 和 4-1BB),CAR-NK細胞還表現出在 NK 細胞信號傳導中具有更高共刺激特異性的特化分子(例如,DAP10、DAP12 和 2B4) ,如CAR構造部分所述。臨床前數據表明,用這些共刺激分子改造的CAR-NK細胞具有增強的細胞毒性殺傷能力。
第三,制造CAR-NK細胞的過程比制造CAR-T細胞的過程更方便。由于不存在GVHD的風險,因此可以從匹配或 HLA 不匹配的供體中分離 NK 細胞,從而為可能的供體提供更多選擇并提高最終產品的質量 。各種來源的NK細胞(例如,NK92 細胞系、PBMC衍生的NK細胞、UCB衍生的 NK 細胞和 iPSC 衍生的 NK 細胞)已用于生成CAR-NK細胞。因此,GVHD的低可能性和各種來源的NK細胞可能使 NK 細胞成為“現成的”產品,可以隨時用于臨床使用。
04
總結
CAR-T細胞的出現是癌癥免疫療法的一個突破,尤其是對于B細胞惡性腫瘤。然而,由于存在CRS、神經毒性和GVHD等嚴重不良反應的風險,研究重點已從CAR-T細胞轉移到CAR-NK細胞。已經進行了臨床前研究和臨床試驗,以確認 CAR-NK 細胞療法治療血液系統惡性腫瘤的安全性和有效性。到目前為止,只有兩項臨床試驗發表了可用數據。仍在熱切期待正在進行的臨床試驗的結果。
NK細胞作為用于基于CAR的免疫治療的新型效應細胞,展現出其獨特的優勢。與 CAR-T 細胞不同,CAR-NK 細胞可以通過 CAR 依賴和非 CAR 兩種方式攻擊腫瘤。NK細胞的豐富來源和缺乏HLA匹配限制使得可以提前生產并準備用于臨床的“現成”CAR-NK細胞產品的產生。此外,由于不良事件發生率低,CAR-NK細胞比CAR-T細胞更安全。然而,也存在影響CAR-NK細胞功能和功效的挑戰。NK細胞對凍融過程敏感,會降低其抗腫瘤能力和存活率。此外,有限的擴展和持久能力也是CAR-NK細胞的一個限制。許多方法仍在研究中,以進一步減少副作用并改善 CAR-NK 細胞的功能。目前,CAR-NK細胞療法的臨床試驗主要針對r/r患者。因此,CAR-NK細胞的潛在應用也有待探索。
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/7180.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃