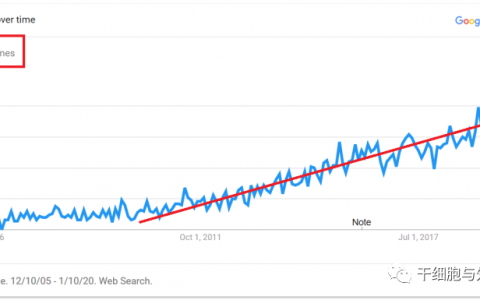
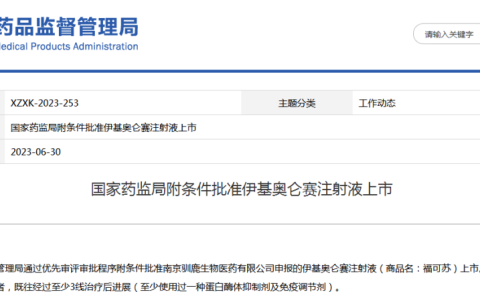
隨著全球細胞與基因治療產業邁入了高速發展期,當前全球已登記的細胞與基因治療相關臨床試驗已超過7000余項,其中近3000項已完成臨床試驗研究,并進行了數萬例干細胞移植。
國內干細胞藥物注冊也正處在蓬勃發展的趨勢中,自從2018年國家藥品監督管理局藥品審評中心(CED)重新受理干細胞新藥臨床試驗申報以來,干細胞藥物臨床試驗的申請穩步增長。就承辦受理號總量,從2018年申報5個(以受理號計)增長至2022年的26個,較2021年度增長了一倍,我國干細胞新藥研發速度明顯加快。
?
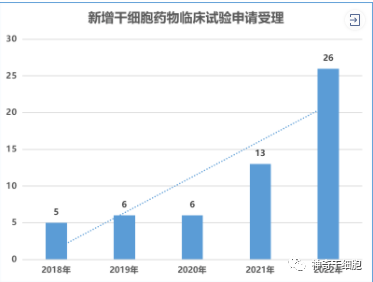
表1 2018-2022年干細胞藥品申報一覽
?
01申報情況
2022年CDE受理干細胞藥物臨床申請26項(以受理號計),其中國產1類創新藥注冊申請25項,進口1類創新藥注冊申請1項。進口干細胞藥物為Cytopeutics臍帶間充質干細胞(Neuroncell-EX)
?
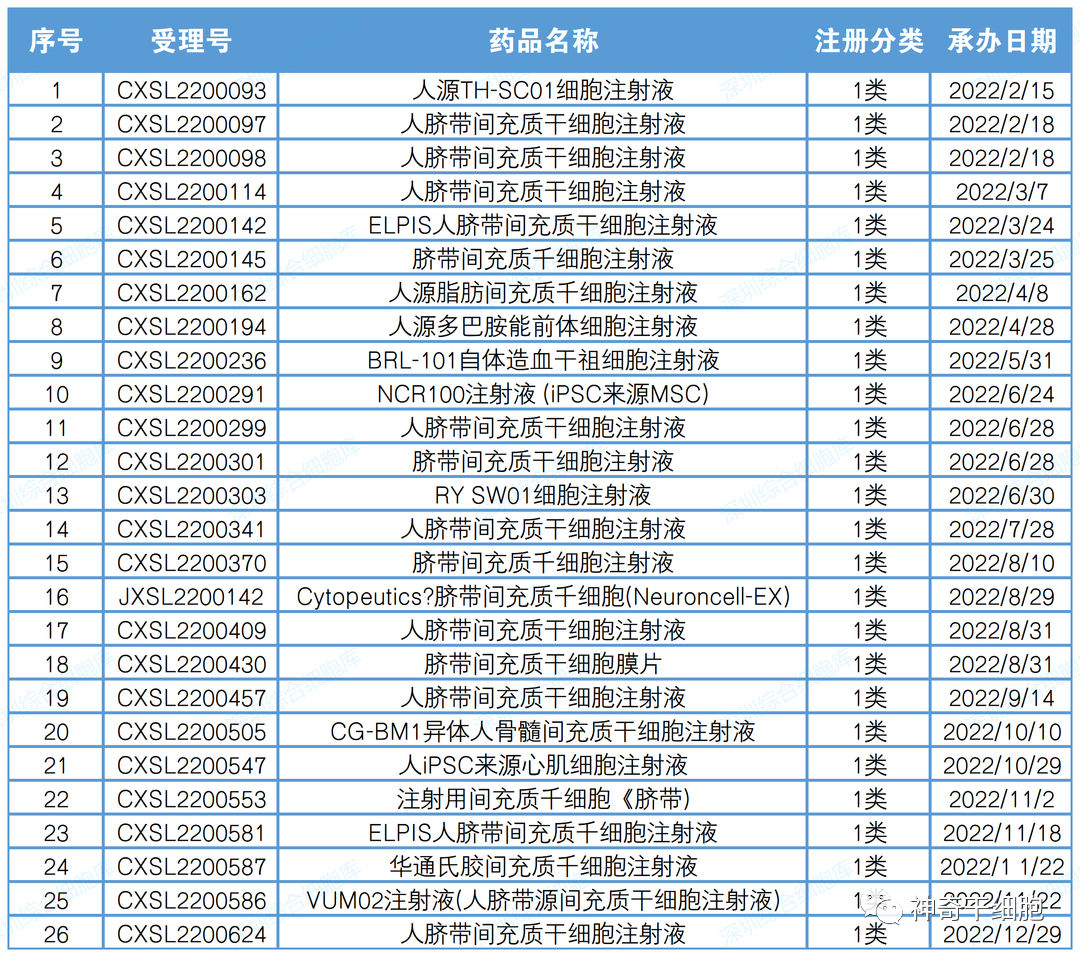
表2 2022年度干細胞藥物注冊申請受理清單
02臨床試驗默示許可情況
2022年CDE合計默許許可11款干細胞藥物的16項臨床試驗。其中使用間充質干細胞的有11項,間充質干細胞使用類型占比達到68%。
?
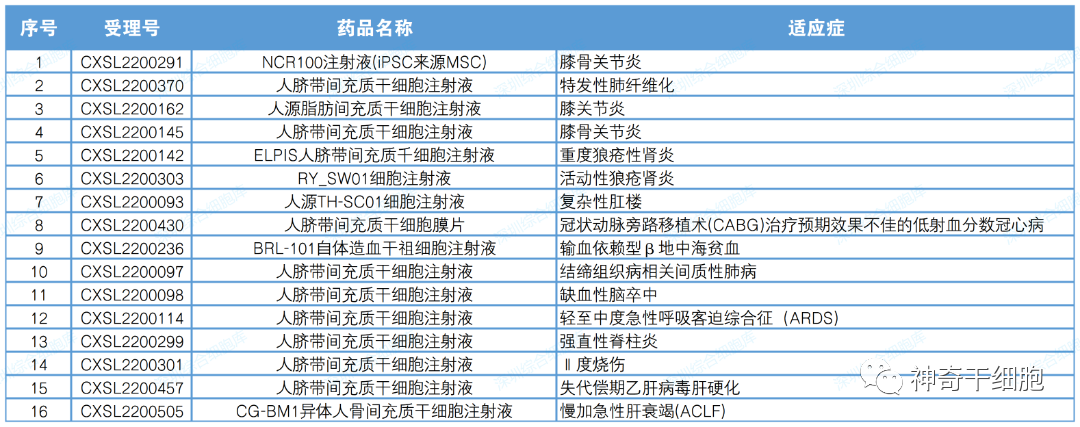
表3 2022年度干細胞藥物臨床默示許可一覽表
03臨床試驗適應癥分析申報的干細胞類型分析
截至2022年12月31日,CDE合計默許的42項臨床試驗涉及20項適應證。其中位于前三的分別是:膝關節炎(7項)、間質性肺病(主要是特發性肺纖維化)(5項)、移植物抗宿主病(GVHD)(4項)。其中膝骨關節炎的7款干細胞藥物,干細胞類型包括:自體脂肪間充質干細胞(1種)、異體脂肪間充質干細胞(2種)、臍帶間充質干細胞(3種)、人誘導多能干細胞來源的間充質樣細胞(1種)。從適應證來看,絕大多數藥物利用間充質干細胞的免疫調控能力以針對炎癥相關或自身免疫系統相關等疾病展開治療。干細胞藥物針對的適應證情況。
?
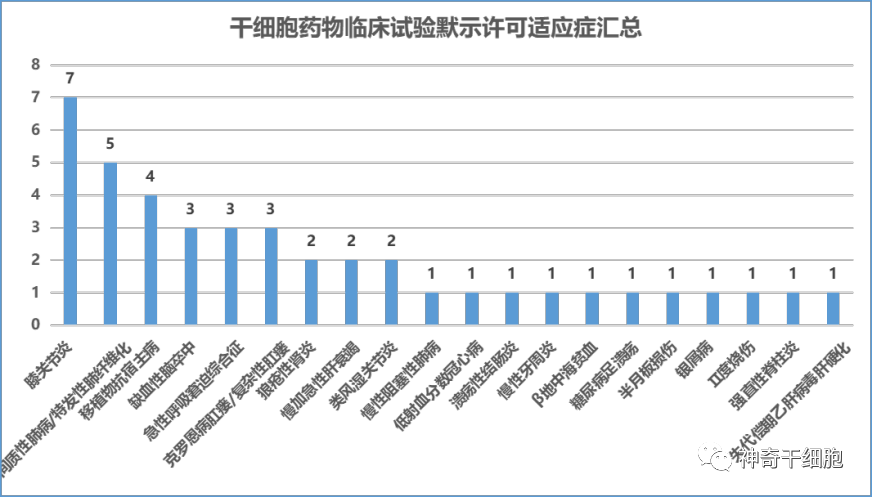
表4 2018-2022年干細胞藥品適應癥詳情
?
2023年干細胞申報或迎來更大的爆發
編輯:小果果,轉載請注明出處:http://www.448371.com/zixun/hydt/24801.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃