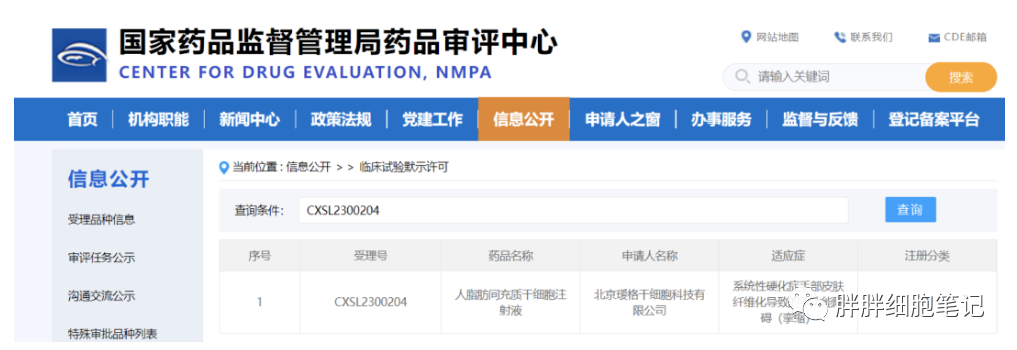
??????北京璦格干細胞科技有限公司(以下簡稱“璦格干胞”)研發的“人脂肪間充質干細胞注射液”(代號:AG1001)獲批IND,適應癥:系統性硬化癥手部皮膚纖維化導致的手功能障礙。
一、研究目標:
????主要目的:觀察人脂肪間充質干細胞注射液局部注射用于系統性硬化癥手部皮膚病變的安全性和耐受性。?
????次要目的:觀察人脂肪間充質干細胞注射液局部注射用于系統性硬化癥手部皮膚病變的初步有效性。
????探索性目的:(1)探索人脂肪間充質干細胞注射液局部注射用于治療系統性硬化癥手部皮膚病變的肺部相關指標的變化;(2)探索人脂肪間充質干細胞注射液局部注射用于治療系統性硬化癥時手部改良的Rodnan皮膚厚度積分(mRSS)較基線的變化情況。??
????治療疾病:系統性硬化癥手部皮膚病變??
????? 倫理:中國醫學科學院北京協和醫院藥物臨床試驗倫理委員會
三、入組標準:
? ? 1.年齡 18~60 歲(含臨界值),性別不限;?
? ? 2.根據 2013 年美國風濕病學會/歐洲抗風濕聯盟系統性硬化癥(SSc)診斷標準,診斷為彌漫皮膚型或局限皮膚型(①無新發臟器受累的臨床表現;②原有受累臟器臨床表現穩定);
??? 3.CHFS≥20(總分 90),伴或不伴皮膚潰瘍;
??? 4.入組前允許口服小劑量糖皮質激素治療(潑尼松≤10mg/天或等效劑量),但要求入組時已應用≥8 周且維持穩定劑量≥28 天;?
??? 5.依從性好,能夠理解并配合完成相應的檢查操作,愿意按照方案的要求用藥并按時接受隨訪檢查的受試者;?
??? 6.自愿參加試驗,理解并簽署知情同意書的受試者。
四、排除標準:
??? 2.三個月內全身病變有進展的表現,如出現活動后氣短加重、急性腎功能不全等表現,需要調整免疫治療藥物或住院治療;?
??? 3.合并有不適合手術的其他疾病,如嚴重的心腦血管疾病、感染性疾病、出凝血功能障礙等;?
??? 4.重疊其他風濕免疫性疾病,如RA、SLE、皮肌炎等(原有風濕免疫性疾病未累及手部且不影響手部安全性及療效評價者除外);5.入組時口服潑尼松>10mg/天(或等效劑量),或維持穩定劑量不足28天,或停用口服糖皮質激素不足14天,或入組前14天內曾應用靜脈糖皮質激素;?
??? 6.入組時應用羥氯喹等抗瘧藥物或雷公藤多苷等植物制劑維持穩定劑量不足3個月,或停用不足14天;?
??? 7.既往接受過干細胞治療,或對細胞治療不耐受;?
????8.1年內接受過CD20單抗治療的患者;?
??? 9.篩選期3個月內使用過生物制劑和小分子靶向藥物的患者;?
??? 10.篩選前5年內發生惡性腫瘤者;或腫瘤標志物檢測異常,且經研究者判斷存在腫瘤風險者;?
??? 11.有證據表明受試者目前存在可能影響安全性的消化系統、泌尿系統、心腦血管、血液系統、神經系統、精神及代謝性疾病,如血糖控制不佳的糖尿病,血壓控制不佳的高血壓等;?
??? 13.篩選時存在以下任何實驗室檢查結果:血紅蛋白1.5×正常值上限(ULN);篩選時總膽紅素>1.5×ULN;估計腎小球濾過率(GFR)
??? 14.血清病毒學(HBsAg、HCV抗體、HIV抗體、梅毒螺旋體抗體)檢查陽性者,其中乙肝病毒攜帶者、經藥物治療后穩定的乙肝患者(HBV DNA<2000 IU/mL或者10000 copies/mL)和已治愈的丙肝患者(HCV RNA檢測陰性)經研究者判斷合格后可以入組;
??? 15.對人血白蛋白、麻醉藥物或人脂肪間充質干細胞注射液中任一成分過敏者,或有嚴重過敏史研究者判定不適合入組者;
??? 16.篩選前3個月內參與任何其他臨床試驗的受試者;
??? 17.由研究者判斷對于局部麻醉風險較高者;
??? 18.妊娠期或哺乳期女性,或篩選期人絨毛膜促性腺激素β(β-HCG)檢測呈陽性者,或不能和不愿意在研究期間及研究結束后6個月采取有效的非藥物避孕措施者;
??? 19.研究者認為不適宜進入本項試驗的其他情況。
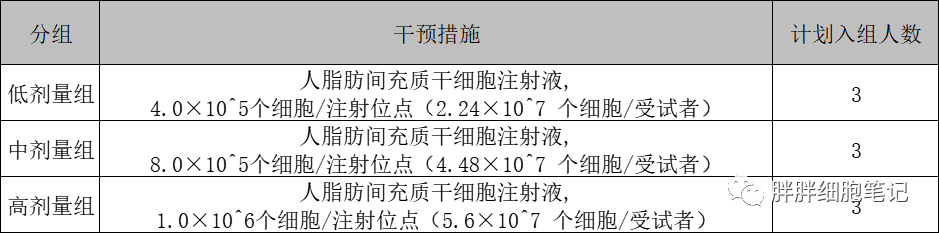
五、分組及干預措施
六、主要研究者
????北京協和醫院整形外科主任?龍笑
? ? Email :pumclongxiao@126.com
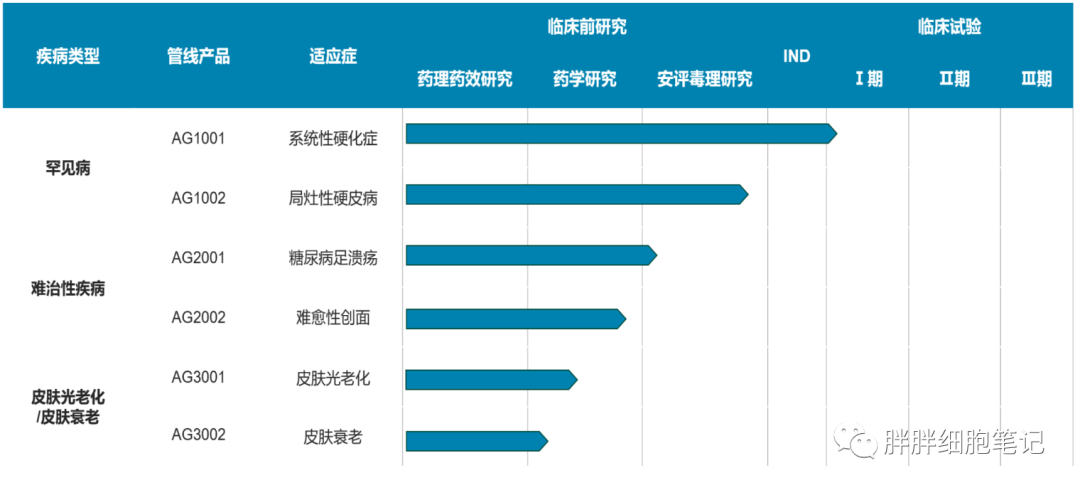
七、北京璦格干細胞科技有限公司在研管線:
(公司官網)
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lczm/37297.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。





 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃