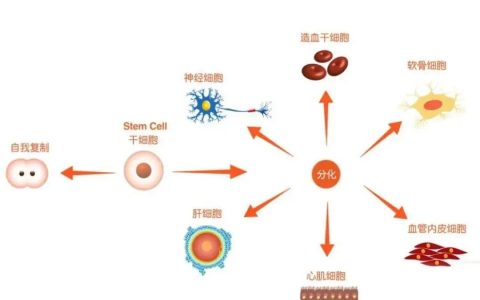
|
試驗題目 |
CTA30X細胞注射液治療復發或難治性急性B淋巴細胞白血病患者的安全性研究 |
||||||||||||
|
試驗制劑名稱 |
CTA30X細胞注射液 |
||||||||||||
|
適應癥 |
復發性或難治性CD19和/或CD22陽性急性B淋巴細胞白血病 |
||||||||||||
|
預期病例數 |
B-ALL不超過18例 |
||||||||||||
|
研究中心 |
安徽省立醫院、北京大學深圳醫院、河北燕達陸道培醫院 |
||||||||||||
|
大致需要住院 |
14-28天 |
||||||||||||
|
試驗設計 |
? 采用單臂、開放標簽、單中心設計。?
? 本試驗在劑量爬坡階段完成所有可評價DLT的受試者的入組及DLT觀察后,進入最長為期1年的療效探索階段;在各組得出安全性結論后,研究者可根據治療反應選擇相應的劑量組擴增病例,但總病例不得超過18例(擴增病例不進行DLT評價)。
? 既往試驗在低劑量水平初步驗證了本品的安全性,本試驗為較高劑量組的安全性驗證以及探索有效性數據。劑量遞增設計參考3+3劑量遞增,共設置3個劑量水平:
?劑量遞增參考3+3劑量遞增原則。每個劑量組預計入組3例受試者。 1)?劑量遞增從最小劑量開始,不可同時進行2個及以上劑量組的遞增研究; 2)?每個劑量組如有1例發生DLT,則該劑量水平將擴展至6例受試者。如果該劑量水平6例受試者≥2例受試者發生DLT,則該劑量水平超過了MTD。前一個較低劑量水平將擴展到6例受試者,如果前-個較低劑量水平已經有6例受試者入組,且這6例受試者中只有≤1例受試者發生DLT,則該較低劑量水平即可視為MTD。 3)?若最高劑量組水平≥2例受試者發生DLT,則研究者可根據具體情況在高劑量組及中劑量組中間選擇一個劑量,行MTD評價。 4)?若劑量遞增至最高劑量組仍未達到DLT,研究者可根據具體情況探索更高劑量的安全性及有效性。 DLT定義: 參照CTCAE5.0,觀察期為輸注后28天。 1)?CTA30X輸注后≥G4的CRS或ICANS;輸注后持續≥14天G3的CRS或ICANS;≥G3的GvHD(分級參照NCCN HCT Version1.2020) 2)?血液系統:與CTA30X治療可能相關的至輸注后28天仍未解決的≥G4的毒性反應(淋巴細胞減少除外)。 3)?非血液系統:28天內發生的與CTA30X治療可能相關的≥G4毒性反應。 4)?豁免:LTLS及1級TLS(Cairo-Bishop分級)、≤24小時內無法糾正的G3電解質紊亂、低蛋白血癥、≤G4發熱或發熱伴中性粒減少、持續≤3天的G4肝功能異常。 病例擴展: 在所有劑量組完成DLT評價后,研究者可根據治療反應選擇相應的劑量組擴增病例,但總病例不得超過18例(擴增病例不進行DLT評價)。 |
||||||||||||
|
入選標準 |
1)年齡≥3且<70歲,性別不限,種族不限; 2)按照美國國家綜合癌癥網絡(NCCN)急性淋巴細胞白血病臨床實踐指南(2020.v2)的標準,經流式檢測確診為CD19+ 和/或CD22+B-ALL的患者; 3)符合復發/難治 B-ALL診斷,包括以下任何一種情況: a)經標準化療2個周期未獲得CR; b)首次誘導達CR,但CR持續時間≤12個月; c)首次或多次挽救性治療后無效的復發/難治 B-ALL; d)造血干細胞移植后復發,包括血液學復發及微小殘留病(MRD)陽性; 4)費城染色體陰性(Ph-)的受試者;或不能耐受酪氨酸激酶抑制劑(TKI)治療或對兩種TKI治療無反應的費城染色體陽性(Ph+)的受試者(t315i突變者可接受一種TKI治療無反應者); 5)血清總膽紅素≤2倍正常值上限,血清ALT和AST均≤正常值范圍上限的3倍,血肌酐≤1.5倍正常值上限; 6)超聲心動圖顯示左心室射血分數(LVEF)≥50%; 7)篩選前1周內受試者未接受放療、化療、單抗治療或其他抗腫瘤治療; 8)預估生存期在3個月以上; 9)ECOG評分0-2分; 10)受試者或其法定監護人自愿參加本試驗,并簽署知情同意書 | ||||||||||||
排除標準 |
1)?根據WHO分類診斷為慢性髓系白血病淋巴母細胞性危象; 2)?患有遺傳性綜合征如Fanconi貧血,Kostmann綜合征,Shwachman綜合征或任何其他已知的骨髓衰竭綜合征; 3)?對細胞產品中任何一種成分有過敏史者; 4)?未被控制的活動性CNSL; 5)?根據美國紐約心臟病協會(NYHA)心功能分級標準,屬于III級或IV級的心功能不全受試者; 6)?心肌梗死,心臟血管成形術或支架術,不穩定型心絞痛或在入組12個月內,臨床上有其它嚴重的心臟疾病;? 7)?心電圖提示有QT間期明顯延長,既往患有嚴重心律失常等嚴重心臟病者; 8)?嚴重的活動性感染,并且未得到有效控制(單純性尿路感染、細菌性咽炎除外); 9)?受試者有其它原發性癌癥史,以下情況除外: a. 經切除治愈的非黑色素瘤如皮膚基底細胞癌; b. 充分治療后無病生存期≥2年的宮頸原位癌、局部前列腺癌、導管原位癌; 10)?需要治療的自身免疫性疾病受試者,免疫缺陷或需要免疫抑制劑治療的受試者; 11)?患有移植物抗宿主病(GvHD); 12)?篩選前4 周內有活疫苗接種; 13)?受試者有酗酒、吸毒或精神疾病史; 14)?篩選時若受試者乙肝表面抗原陽性且乙肝病毒PCR>正常值上限者,丙型肝炎、艾滋病、梅毒抗體陽性且梅毒DNA檢測超過正常值上限; 15)?CAR-T輸注期間必須使用類固醇激素者,(局部或使用吸入性類固醇激素者除外); 16)?篩選前2周內參加過其它臨床試驗者; 17)?妊娠、哺乳期女性以及有生育能力而不能采取有效避孕措施的受試者(無論男女); 18)?研究者認為可能增加受試者風險或干擾試驗結果的任何情況。 |
||||||||||||
|
試驗過程 |
1.?一、簽署知情同意書 在進行任何與研究有關的操作和評估前,必須獲得受試者或其法定監護人簽名并簽署日期的倫理委員會審核通過的《知情同意書》。 2.?二、篩選期檢查、入選并分配入選號 篩選期檢查包括病史、體格檢查、生命體征、心電圖以及實驗室檢查等。 簽署知情同意書的每個受試者都將分配一個唯一的篩選號。 三、化療預處理 在細胞輸注(第0天)前的第-7到?-3天,受試者需要接受基于“氟達拉濱+環磷酰胺”(FC方案)化療預處理。研究者可根據具體情況調整給藥劑量及療程,或加用其他藥物。 推薦的預處理方案: 氟達拉濱30mg/m2/d,靜脈輸注,1次/日,連續5天; 環磷酰胺400mg/m2/d,靜脈輸注,1次/日,連續5天; 清淋預處理研究者可以根據受試者病情情況,做適當調整。 CTA30X應在化療預處理完成48小時后方可進行。 四、CTA30X治療與觀察 CTA30X輸注當天定義為D0。治療方式采用靜脈輸注方式。 五、隨訪 按照方案規定的時間點進行隨訪,并完成檢測項目、安全性和有效性的評估。 |
||||||||||||
|
統計分析 |
安全性數據包括試驗期間觀察的不良事件及實驗室數據在治療前后的變化。不良事件采用統計描述計算每種不良事件的發生率以及不良事件的總體發生率。 |
? ?招募I復發/難治的急性B系淋巴細胞白血病患者
?一項名為?“CTA30X細胞注射液治療復發或難治性急性B淋巴細胞白血病患者的安全性研究”的臨床試驗正在合肥、深圳和廊坊開展。已有臨床試驗證實該類藥物在急性B淋巴細胞白血病領域有良好的抗腫瘤療效,可為急性B淋巴細胞白血病患者提供一種新的治療方式。在該血液瘤適應癥上開展的臨床前體外、體內有效性模型中均展現較好的抗腫瘤活性,且安全性較好。
?招募對象的條件:
?針對急性B淋巴細胞白血病的要求:
? 1)年齡≥3且<70歲,性別不限,種族不限;
? 2)按照美國國家綜合癌癥網絡(NCCN)急性淋巴細胞白血病臨床實踐指南(2020.v2)的標準,經流式檢測確診為CD19+和/或CD22+B-ALL的患者;
? 3)符合治療復發/難治B-ALL診斷,包括以下任何一種情況:
? 經標準化療2個周期未獲得CR;
? 首次誘導達CR,但CR持續時間≤12個月;
? 首次或多次挽救性治療后無效的復發/難治B-ALL;
? 造血干細胞移植后復發,包括血液學復發及微小殘留病(MRD)陽性;(最終標準由研究醫生掌握)。
溫馨提示
如果您或您身邊的朋友滿足招募要求,并且有意向參與該臨床試驗,可聯系研究醫生,或攜帶全部臨床資料來醫院血液科就診,研究醫生將會詳細介紹該臨床試驗的具體內容。
|
中心名稱 |
聯系方式 |
|
安徽省立醫院 |
18326632997-疏老師 |
|
北京大學深圳醫院 |
18326632997-疏老師 |
|
河北燕達陸道培醫院 |
13146362915劉老師 |
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lczm/23820.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃