細胞外囊泡 (EV) 是細胞間通訊的載體,在生理和病理條件下從各種細胞類型中釋放出來。近日,來自山西醫科大學口腔醫學院王興、任秀云課題組的研究人員在Journal of Controlled Release雜志上發表綜述,回顧了EV和外泌體的生物發生機制、調節EV釋放的方法和治療進展,并探討了EV的副作用和目前挑戰。
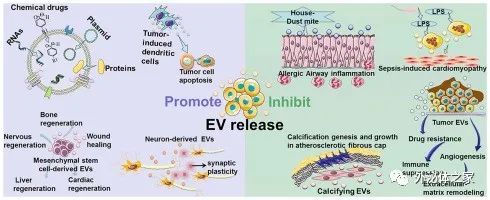
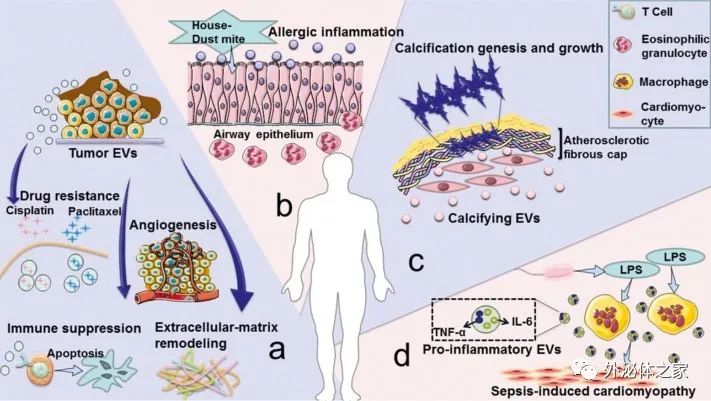
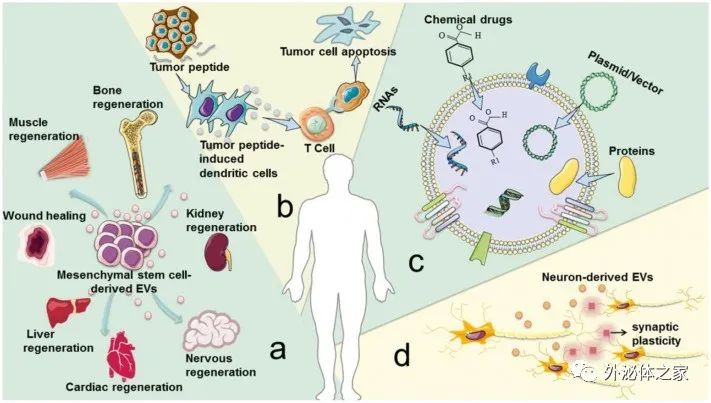
細胞外囊泡 (EVs) 在病理生理條件下從細胞中釋放出來,并可以從各種體液中分離出來。根據其生物發生機制,EVs 分為三種類型:外泌體(30-100nm EVs 來源于內吞途徑);微泡 (MV)(從質膜萌芽的 50-1000nm EV);凋亡小體(來自凋亡細胞的 1-5-μm EV)。目前的研究側重于前兩種類型的囊泡,并將它們統稱為EV。EV 以兩種方式介導復雜的細胞間信息的交換,并作為一種有價值的治療方法(如圖1所示)。有幾個例子說明了EV在治療疾病方面的作用。(1) 在很大程度上,間充質干細胞衍生的 EV具有間充質干細胞所具備的組織再生和損傷修復作用。(2) 腫瘤肽激活樹突狀細胞來源的EV誘導強烈的抗腫瘤免疫反應,可用作無細胞抗癌疫苗。(3) EVs 是理想的藥物輸送載體,易于循環、避免免疫排斥并降低某些風險,例如不受控制的細胞分裂和致癌細胞污染。(4) 大腦中的神經元通過釋放EV進行交流,促進局部和遠端突觸可塑性。然而,目前的生產方法產生的EV產量低,而臨床疾病治療需要大量的EV。例如,為了實現生物學結果,小鼠每次治療通常需要109-1011EVs的劑量,這可能需要數升條件培養基和幾個月時間的收集。EV產量不足極大地阻礙了其臨床應用,因此為了克服實施無細胞療法的這一瓶頸,提高EV的產量和質量至關重要。?除了作為治療方法外,EVs 也是疾病進展的加速因素(如圖2所示)。(1) 腫瘤來源的 EVs 誘導免疫抑制、腫瘤血管生成、化療耐藥和基質重塑,促進腫瘤的發展和轉移。(2) 氣道分泌的 EVs 參與過敏原暴露下過敏性氣道炎癥的發病機制。(3) 心血管組織的平滑肌細胞釋放鈣化 EVs,這些 EVs 在動脈粥樣硬化的病理條件下包含有促進鈣化的貨物,一旦這些 EVs 被釋放到細胞外基質中,它們就有聚集形成斑塊的嚴重風險。(4) 膿毒癥期間被脂多糖刺激的巨噬細胞會釋放更多含有促炎細胞因子的 EV,這種 EV 的增加與心肌功能障礙的進展有關。關于 EV 在癌癥、創傷、自身免疫性疾病、傳染病和心血管疾病中的作用的類似研究已經發表了很多。因此,抑制EV釋放以減輕疾病的負面影響已成為一種新的治療策略。
因此,在生理條件下,EV介導細胞間和組織間的通訊并參與維持體內平衡。某些EV類型已成為生物治療劑,例如無細胞再生醫學、藥物遞送和免疫治療。但EV的低產量是這些療法大規模實施的瓶頸。相反,微環境中更多的 EV促進腫瘤轉移、病毒顆粒傳播和神經退行性疾病的傳播,抑制EV分泌可能會延遲疾病進展。因此,EV釋放的促進和抑制具有巨大的研究潛力和廣闊的應用前景,是一個新的、有發展前景的領域。在這篇綜述里,研究人員回顧了基于 EV 生物發生機制的 EV 釋放的調節方法、治療機會,并考慮了EV應用上的副作用和挑戰。
參考文獻:Promotion or inhibition of extracellular vesicle release: Emerging therapeutic opportunities. J Control Release. 2021 Oct 22:S0168-3659(21)00548-4.
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lcyj/6628.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。






 微信掃一掃
微信掃一掃
 支付寶掃一掃
支付寶掃一掃