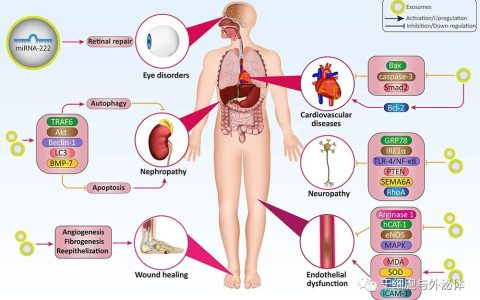
研究細胞外囊泡(EV)的可靠生物活性和藥物發現需要開發一種新的大規模純化方案。為了解決這個問題,近日JEV雜志上的一篇文章提出了一種通過使用陰離子交換法制備高性能外泌體(EXO)的有效方法。來自4L培養上清液的細胞毒性T淋巴細胞(CTL)EV通過220nm截止過濾器分為兩個群體,去蛋白率超過99.97%,分別在低(0.15M–0.3M)和高NaCl濃度(0.3M–0.5M)條件下洗脫(分別約為2×1012和1.5×1012顆粒)通過陰離子交換柱色譜。前者富含EXO蛋白,包括晚期內體相關蛋白和rab家族和整合素家族蛋白,以及功能性微(mi)RNA,并具有通過消耗原發性腫瘤病變中的間充質細胞群來預防腫瘤轉移的生物活性。相比之下,后者是微泡(MV)樣顆粒,包括DNA、核心組蛋白和核糖體蛋白,以及功能未知的富含GC的miRNA,容易被甘露糖受體+枯否細胞吞噬。因此,陰離子交換法適用于大規模分離具有生物活性的EXO和類似MV的EV,后者攜帶高純度危險核酸貨物。

包括免疫細胞在內的多種細胞會釋放脂質雙層膜細胞外囊泡(EV),例如晚期內體衍生的外泌體(EXO,也稱為小EV)和質膜出芽形成微泡(MV,也稱為大EV,包括凋亡小體、oncosomes和ectosomes),直徑分別為50-200和100-2000nm(直徑約為100-200nm的EV是EXO和MV的混合物)。最近報道了直徑小于50nm的非膜外泌顆粒(exomeres)。EXO來源于內溶酶體系統,并通過由外泌體標記蛋白(例如凋亡相關基因2相互作用蛋白X(Alix)和腫瘤易感基因(Tsg)101)介導的轉運所需的內體分選復合物 (ESCRT)介導多泡體[MVB]作為腔內囊泡(ILV)生成,并通過MVB與質膜融合而釋放。然而,通過已知的ESCRT依賴性和非依賴性EXO形成途徑以及來自腫瘤細胞系的EV中微(mi)RNA和蛋白質的不同包裝機制,從單個細胞系釋放的EV是結構異質的群體。在臨床使用的EV藥物發現中,關鍵是根據其功能確定顆粒類型并盡可能對其進行分離和純化。
與質膜來源的MV不同,據預測,EXO膜富含由以鞘磷脂和神經節苷脂為代表的鞘脂,已知它們通過阻斷神經酰胺生物合成和積累四跨膜蛋白分子(如CD9、CD63和CD81)來防止晚期內體中的ILV出芽;另外還富含糖基-磷脂酰肌醇錨定蛋白,例如CD90、G蛋白偶聯受體和膽固醇。據報道,在一項使用具有高分辨率密度梯度的分級EV的研究中,EXO不含DNA。此外,一份報告指出,在前列腺癌患者的血漿中,大型EV而非小型EV含有DNA。所有類型的EV都被廣泛認為表現出負電荷,因為位于活細胞質膜內葉的陰離子磷脂酰絲氨酸(PS)暴露在EV膜的外葉上,如同死細胞那樣。有趣的是,一些研究報告稱,與其他EV相比,EXO對PS結合蛋白AnnexinV和lactadherin的親和力較弱,這表明EXO可以根據細胞膜負電荷的差異與源自質膜的EV分離。
基于超速離心(UC)的分離技術被廣泛用作表征EV生物學意義的金標準方法。除了無法區分MV、EXO和exomeres外,在應用UC方法時,培養上清液中的不溶性聚集蛋白也會與EV一起沉淀。在定量實驗固有的困難下,EV之間的聚集以及培養基衍生蛋白質與EV的非特異性結合顯著損害了UCEV生物活性的可靠性。使用碘克沙醇的密度梯度離心和使用對CD9、CD63和CD81四跨膜蛋白分子特異的mAb以及對PS特異的T細胞免疫球蛋白和含有粘蛋白結構域的分子4(TIM-4)的親和分離經常用于EV制備。盡管基于密度梯度和親和力的方法可以獲得高純度的EV,但很難制備大量EV用于物理化學分析和研究EV的詳細生物學特性。此外,在PS靶向制備方法中,可能會遺漏具有低負膜電荷的EV。
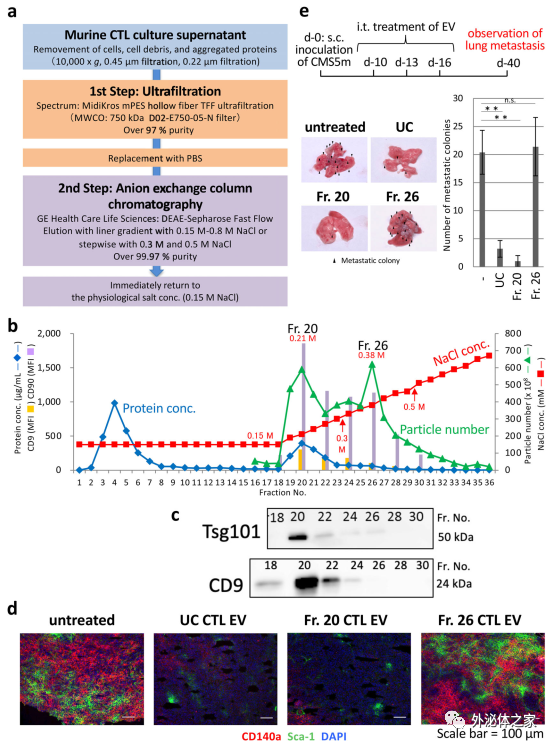
DEAE柱色譜法在低鹽濃度下洗脫生物活性CTL EV
作者此前在鼠類研究中闡明,CD8+CTL EV通過其內容物(例如miR-298-5p)調節原發性腫瘤病變中的間充質細胞群來預防腫瘤轉移。這項研究描述了一種基于這種生物學特性的高純度大規模EV制備方法,使用陰離子交換法,并闡明了詳細的生理特征,包括蛋白質、膜脂和miRNA分布以及DNA含量,表面糖基化和靶細胞特異性。得出結論,陰離子交換法最適合臨床應用中符合良好生產規范(GMP)的EV制備。
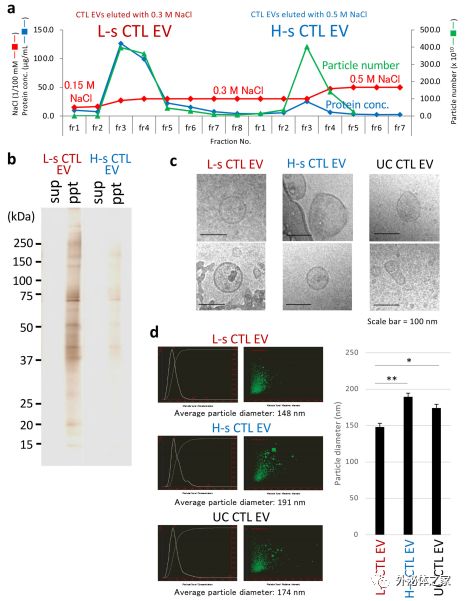
純化的L-s和H-s CTL EV的形態和粒徑差異
參考文獻:
SeoN,
Nakamura J, Kaneda T, Tateno H, Shimoda A, Ichiki T, Furukawa K,
HirabayashiJ, Akiyoshi K, Shiku H. Distinguishing functional exosomes
and otherextracellular vesicles as a nucleic acid cargo by the
anion-exchange method. JExtracell Vesicles. 2022 Mar;11(3):e12205. doi: 10.1002/jev2.12205.PMID: 35289089.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/wmt/11548.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃