介紹
隨著嵌合抗原受體(CAR) T細胞的近期發展和出現,過繼性細胞療法發生了革命性變化。這些是經過改造的T細胞,在細胞膜上具有單鏈可變片段(scFv),可識別腫瘤抗原并能促進抗腫瘤活性。典型的第一代CAR構建體由融合跨膜結構域和細胞內信號單元(CD3 zeta鏈)的scFv組成,可實現腫瘤特異性表位識別和T細胞活化,而不依賴于主要組織相容性復合物。
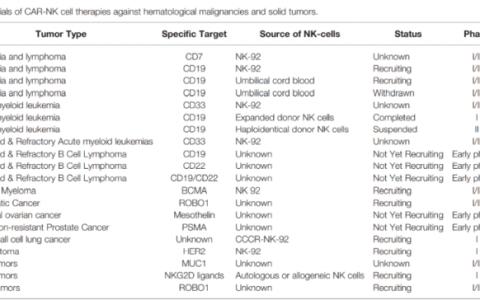
該技術的發展為血液系統惡性腫瘤的治療產生了持續的抗腫瘤反應和前所未有的結果。隨著抗CD19 CAR-T細胞的初步臨床成功,以及KYMRIAH? (tisagenlecleucel)和YESCARTA? (axicabtagene ciloleucel) 的監管批準),CAR-T 細胞的臨床管線已大幅增加,目前在不同的臨床試驗中正在研究≥90種 CAR-T細胞治療候選藥物。盡管最初的臨床研究僅限于血液系統惡性腫瘤,但該領域正在迅速向潛在發展方向發展用于實體瘤靶點。
CAR對腫瘤抗原的識別和參與導致CAR-T細胞的激活、腫瘤細胞的細胞溶解和細胞因子的釋放。細胞因子隨后促進了CAR-T細胞的快速擴增,隨后促進了它們的記憶分化。盡管對CAR-T細胞的作用機制已經有了普遍的了解,但潛在的關鍵決定因素對影響其速率和程度的定量影響CAR-T細胞活性仍然知之甚少。
CAR-T細胞的藥代動力學-藥效學(PK-PD)關系的表征由于其在體內的自我復制和長期持續能力而呈現出許多挑戰和獨特的機遇。CAR-T細胞的典型多相處置概況包括快速分布階段導致有時間限制的擴張階段,然后是收縮和延長的持續階段。盡管最近已經使用數學模型來表征CAR-T細胞的不同PK曲線,但無法利用經驗模型來了解藥物和系統特定參數如何促成這種獨特的PK行為。因此,開發基于機制的轉化PK-PD 模型,將關鍵的藥物特異性和系統特異性參數整合到一個定量框架中,對于理解CAR-T細胞的關鍵PK-PD決定因素是非常寶貴的。
這樣的模型可以:(1)促進先導 CAR 結構的設計和開發,(2)在臨床前環境中對先導CAR-T候選物進行分類,以及(3)實現有效的臨床前到臨床轉化。
在這里,我們采用逐步方法開發多尺度、機械PK-PD模型,使用針對多種CAR結構報告的一組綜合文獻數據,定量描述體外和體內臨床前模型中的CAR-T細胞活性。
在第1步中,開發了細胞級PD模型以定量表征藥物特異性(例如,CAR親和力和 CAR密度)和系統特異性(例如,抗原密度、腫瘤負荷)參數對體外的影響CAR-T細胞活動,包括腫瘤細胞耗竭、CAR-T細胞擴增和細胞因子釋放。
在第2步中,開發了一個基于生理的藥代動力學(PBPK)模型來表征 CAR-T細胞在異種移植小鼠模型中的體內生物分布。
最后,在步驟3中,建立了PBPK-PD模型,以同時表征異種移植小鼠模型中的體內CAR-T擴增和腫瘤細胞耗竭。然后將體外效力與體內估計值進行比較,以建立體外和體內相關性 (IVIVC)。開發的PBPK-PD模型用于進行模擬,以了解CAR-T細胞PK-PD在CAR-T劑量水平和腫瘤負荷變化時的行為。我們在此提出的轉化模型有望提供更好的框架來解釋未來CAR-T細胞的臨床PK-PD行為。
結果
用于表征體外CAR-T細胞活性的細胞水平PD模型
開發了一個數學模型(圖 1a,在方法部分中描述)來表征CAR結合親和力、靶細胞上的抗原表達、T細胞上的CAR表達和不同效應細胞:靶細胞(E:T)與同時定量描述體外靶細胞耗竭、細胞因子釋放和T細胞擴增。為了開發這個體外模型,使用了一個綜合數據集,包括兩種不同的CAR結構,即抗表皮生長因子受體(EGFR) 和抗人表皮生長因子受體 2 (HER2) CAR-T細胞(在表格1)。使用該模型表征的三個定量結果包括:(1) 靶細胞耗竭,(2) CAR-T細胞增殖,和(3)細胞因子(例如干擾素(IFN)-γ)的釋放。
表 1. 用于開發所提出的轉化PK-PD模型的臨床前體外和體內數據集


圖 1. (A) CAR-T細胞活性的細胞級藥效學模型示意圖
?
抗EGFR CAR-T細胞
細胞水平模型用于擬合Caruso等人報道的抗EGFR CAR-T細胞的體外數據集。圖 2描述了觀察到的數據集和模型擬合曲線,用于表達EGFR的U87腫瘤細胞系耗竭(圖 2a ),抗EGFR CAR-T細胞增殖(圖2b)和細胞因子釋放百分比相對于基線水平(圖2c)在具有不同抗原密度(30,899-628,265個受體/細胞)的EGFR+U87細胞系的體外系統中)、CAR親和力(西妥昔單抗與尼妥珠單抗 CAR-T)和E:T比率(1.25:1–20:1)(詳細描述在表1中)。

圖 2. 體外系統中親和力變體抗EGFR CAR-T細胞活性的觀察和模型擬合曲線。
與高親和力西妥昔單抗 CAR-T(紅色輪廓)相比,該模型能夠同時捕獲低親和力Nimotuzumab CAR-T(藍色輪廓)在具有不同腫瘤細胞的 U87 細胞系中的不同腫瘤細胞殺傷潛力。EGFR密度,通過估計關鍵功效參數。該模型使用“CAR-靶標復合物/腫瘤細胞數量”的形成,由于更高的靶標參與度,這將隨著親和力和抗原密度的增加而增加。估計的效力參數值(KCCAR-T50,表 2)表明,需要約1.45個CAR-Target 復合物/腫瘤細胞來誘導CAR-T細胞表現出的最大殺傷率的50%。
表 2.用于構建CAR-T的PBPK-PD模型的固定或估計參數



圖 2b突出顯示了與表達EGFR的U87細胞系共培養后,與未轉導 (CAR-) T細胞相比,西妥昔單抗CAR+ T細胞的擴增。當與抗原陽性腫瘤細胞共培養時,該模型能夠捕獲激活誘導的CAR+ T細胞增強的增殖潛力。根據等式4和11中描述的結構模型,估計的參數(表 2)表明每個腫瘤細胞需要約4.3個CAR-Target復合物才能使CAR-T細胞加倍最大減少50%時間,而在所研究的體外系統中,CAR-T細胞倍增時間(ImaxCAR-TGrowth)的最大可飽和減少估計為44.5%。
圖 2c描繪了在CAR-T細胞的兩種不同親和力變體與不同EGFR表達細胞系相互作用時,與觀察到的數據疊加的模型擬合,用于IFN-γ 的百分比增加(與基線相比)。該模型能夠同時表征一個綜合數據集,以作為時間、EGFR受體密度和CAR親和力的函數,在體外共培養中 IFN-γ 的飽和增加。相關的模型參數(方程12,表 2)反映了在所研究的體外系統中,~0.1 CAR-Target 復合物/腫瘤細胞能夠誘導50%的最大激活誘導細胞因子釋放率。
抗HER2 CAR-T細胞
細胞水平PD模型(圖 1a)還用于表征Liu等人報道的親和力變異抗HER2 CAR-T細胞的體外數據集。圖3描述了觀察到的 HER2 數據集和模型擬合曲線-在綜合體外實驗中表達腫瘤細胞耗竭(圖 3a)、抗HER2 CAR-T細胞增殖(圖 3b)和誘導絕對濃度的IFN-γ(以 pg/mL 為單位,圖 3c) CAR親和力、HER2受體密度、CAR密度和E:T比率(在表 1 中詳細描述)。

圖 3.體外系統中親和力變體抗HER2 CAR-T細胞活性的觀察和模型擬合曲線。
圖 3A描繪了與8小時體外細胞毒性實驗的觀察數據疊加的同步模型擬合曲線,其中四種不同的親和力變體(Kd范圍為3.9μM–0.58nM)的 CAR-T細胞與Nalm-6-CBG共培養細胞系,轉染不同水平的HER2 mRNA。該模型能夠考慮不同的系統特異性決定因素(例如,CAR-親和力、HER2密度)以有效捕獲可飽和殺傷曲線,并估計一組通用的體外功效參數。模型估計的效力(KCCAR-T50,表 2)表明,需要約0.05 個 CAR-Target復合物/腫瘤細胞才能誘導 CAR-T 細胞表現出的最大殺傷率的50%。
圖 3b 描述了與未轉導的T細胞相比,當與具有不同抗原密度的腫瘤細胞共培養7h后,與未轉導的T細胞相比,與觀察到的數據集重疊的模型擬合曲線。數據集的同時表征能夠識別在存在關鍵潛在決定因素(例如 CAR 親和力和抗原密度)的情況下 CAR-T 細胞擴增的速率和飽和程度。參數估計(表 2,等式4 和 11)顯示,需要 0.06 CAR-Target Complexes/腫瘤細胞來實現 CAR-T細胞倍增時間的最大減少 50%,而最大可飽和在體外系統中,CAR-T細胞倍增時間 (ImaxCAR-TGrowth) 的抑制率估計為 59.5%。
圖 3c描述了與K562細胞共培養后的模型擬合曲線,與觀察到的產生IFN-γ(絕對濃度,pg/mL)的數據重疊,用不同水平的 HER2 瞬時轉染,具有親和力變體抗 HER2用不同數量的CAR mRNA轉導的CAR-T細胞(詳見表 1)。所提出的模型結構能夠使用估計的CAR-Target 復合物 (CplxCell) 的數量來同時表征不同數據集中細胞因子釋放的速率和程度。建模結果顯示,每個腫瘤細胞需要約 0.1個CAR-Target復合物才能達到50%的最大細胞因子釋放率。此外,與抗EGFR案例研究一致,在所研究的體外系統中估計了細胞因子釋放的非常快的最大速率 (KMaxCytokine)。
基于生理學的PK模型來表征CAR-T細胞的生物分布
開發了一個 PBPK 模型來表征異種移植小鼠模型中CAR-T細胞的PK和組織分布。開發的模型用于表征來自抗EGFR CAR-T細胞和抗CD19 CAR-T細胞的生物分布數據集。有關CAR結構、CAR親和力、靜脈內(IV)劑量水平、使用和研究的放射性標記的詳細信息與每項研究相關的組織列于表1。模型結構的示意圖如圖1b所示,詳細的模型描述在方法部分提供。
圖 4 描述了與非轉導(CAR-) T細胞 (圖 4a)、抗EGFR CAR+ T細胞 (圖 4b) 和抗CD19 CAR+ T的生物分布數據集同時擬合相關的模型擬合曲線和觀察到的數據點異種移植小鼠模型中的細胞(圖 4c)。所提出的 PBPK 模型同時表征了所有三種CAR構建體的生物分布,以及所有主要器官的一組血管到間質遷移 (JOrgan) 率。在進行模型擬合時,與每個案例研究相關的生理參數(例如,流速、器官體積)以及藥物和系統特定參數(例如,CAR親和力、腫瘤體積、抗原密度),固定為文獻報道的值,如表2和補充表1所列。在用于PBPK的數據集(抗EGFR和抗CD19)中未觀察到腫瘤分布和抗原介導的刺激后CAR-T細胞的擴增模型構建,大概是由于研究的時間點有限,因此沒有包含在模型結構中。然而,CAR-T 細胞擴增后來在開發PBPK-PD關系時實施。

圖 4. CAR-T 細胞在異種移植小鼠模型中的生物分布的觀察和模型擬合曲線。
與提議的 PBPK 模型相關的估計參數包括所有組織的CAR-T細胞生物分布可用的一階遷移率(JOrgan,如參考文獻19,22中所述)(表 2)。對于沒有生物分布數據的其他組織(例如,腦、胃腸道[GI]道、其他),遷移率(JOrgan)固定為 Khot 等人報告的值。
此外,一階消除CAR-T細胞(KLiverel)的比率是根據肝室的血管外空間 (VEVLiver) 估計的,基于多個關于肝臟消除 CAR-T 細胞的報告。由于模型估計的遷移率(Jorgan)是反映不同組織之間的分布率,觀察到T細胞的最大分布在肺、脾和肝中。模型估計的 CAR-T 細胞從肝臟血管外VEVLiver空間中的消除率為0.029 1/h(~ 1-d 半衰期)。
圖4a和4b代表了攜帶U87異種移植小鼠模型的研究組織中未轉導T細胞和抗EGFR CAR-T細胞(CAR親和力:Kd為40nM)的觀察數據和模型擬合圖譜。雖然提出的模型解釋了CAR-Target復合物的形成,與未轉導的T細胞(圖 4a)相比,模型預測的CAR-T細胞(圖 4b)在腫瘤內的生物分布曲線沒有明顯差異。可能的原因之一可能是因為 CAR-T 擴展在靶標參與腫瘤后沒有合并。值得注意的是,三個案例研究的%ID/g非常一致(比較圖4a-c時)。此外,根據抗CD19 CAR-T的生物分布結果,其中施用了三種不同劑量(即1.5、5.6和1700萬個CAR+細胞),觀察到CAR-T細胞水平的動力學約為劑量-在劑量范圍內成正比。因此,從肝臟血管外空間 ((VELViver)) 消除的一階線性速率被用于表征CAR-T細胞的分布。
?
開發PBPK-PD模型來表征異種移植小鼠模型中的體內CAR-T細胞擴增和腫瘤生長抑制
將開發的PBPK模型擴展為具有PD建模組件,該組件使用“每個腫瘤細胞的 CAR-Target復合物數量”作為腫瘤生長抑制(TGI)和CAR-T細胞擴增的驅動因素。模型結構的示意圖如圖1c所示,詳細的模型描述在方法部分提供。
?
抗BCMA CAR-T (bb2121)細胞
圖 5a描述了在單次IV施用5×106抗BCMA(bb2121) CAR+ T細胞后,表達B細胞成熟抗原 (BCMA) 的RPMI-8226異種移植小鼠中TGI和 CAR-T細胞擴增的同時表征/老鼠。如方法部分中詳細描述的,動態(具有生長和殺傷功能)腫瘤隔室(圖 1C)被納入PBPK模型,其中“每個腫瘤細胞的CAR-Target復合物數量”用于驅動功效和擴增腫瘤血管外(VEVTumor)空間中的總CAR-T細胞(未結合和腫瘤細胞結合)。與之前描述的用于PBPK模型開發的生物分布研究相比,隨著該PK-PD研究的持續時間更長和采樣頻率更高(長達28天),觀察到CAR-T細胞在血液隔室中擴增(圖 5A)。

圖 5.CAR-T細胞體內擴增和CAR-T誘導的腫瘤生長抑制的觀察和模型擬合曲線。
在血液中靜脈注射CAR+ T細胞后,早期未觀察到血液中可檢測到的CAR-T細胞水平,突出了快速分布/邊緣階段。該模型能夠捕獲這種獨特的配置文件,如圖5A所示(綠色配置文件)。在與腫瘤血管外空間(VEVTumor)內的腫瘤細胞相互作用后,CAR-T細胞會擴增,最終循環回(通過淋巴流)到血液中(綠色輪廓,圖 5A),如PBPK模型所預測的那樣在圖1B。這種現象可能導致TGI誘導的明顯延遲(紅色輪廓,圖5A)和血液隔室中CAR-T細胞的明顯擴張(綠色輪廓,圖5A)。腫瘤細胞在第14天死亡后,“CAR-Target Complex”驅動信號減少,導致快速收縮階段,此時CAR-T細胞迅速下降,最終符合其基線暴露水平。
有趣的是,模型估計的腫瘤細胞最大殺傷率 (KKillMax) (~0.05 1/h) 和“每個腫瘤細胞的 CAR-Target 復合物數量”(KCCAR-T50)需要 (9.94個復合物/腫瘤細胞) 50%的最大腫瘤耗竭率與抗 HER2 和抗 EGFR CAR-T 細胞的體外估計值相似(表 2)。誘導活化CAR-T細胞擴增所需的模型估計最大速率 (TActMax) 和“每個腫瘤細胞的CAR-Target復合物數量”(ECAct50)分別為0.09 (1/h)和5.18 (復合物/腫瘤細胞)。體內觀察到的T細胞擴增效力估計值(ECAct50)也與之前的體外效力估計值(ICCAR-TGrowth)非常相似,突出了在開發轉化PK-PD關系時采用系統方法的潛在效用。
?
抗HER2 CAR-T細胞
圖5B描述了在皮下接種 HER2-high SKOV3 的異種移植小鼠中的親和力變異(4D5[高親和力] 和4D5-5[低親和力])抗HER2 CAR-T細胞的TGI曲線(觀察和模型擬合)使用圖1C中描述的模型(參見方法部分)。使用提出的PBPK-PD模型對所有數據集(低劑量和高劑量)進行同時表征。所有藥物特異性(CAR親和力和CAR密度)和系統特異性(SKOV3和PC3的抗原密度)參數都固定為已知值,而與腫瘤生長和殺傷相關的參數是估計的(表 2)。由于當前案例研究中缺乏此類數據,與 CAR-T 細胞體內擴增相關的參數被固定為抗 BCMA(bb2121)研究的估計值。
該模型同時表征HER2-high SKOV3和HER2-low PC3 TGI中的TGI的能力支持了 CAR親和力、靶標豐度和CAR-T細胞活性之間的定量關系可以轉化為體內環境,其中與低表達PC3腫瘤相比,低親和力和高親和力CAR-T細胞在高表達SKOV3腫瘤中的相對療效不同。由于4D5-5(藍色輪廓)的結合親和力較低,與高HER2 SKOV3異種移植物相比,預計低HER2 PC3異種移植物中的“每個腫瘤細胞的CAR-Target Complexes”形成較少,最終導致在TGI的分化中。
抗CD19 CAR-T細胞
圖 6表示在接種了表達CD19的HeLa或H929細胞的異種移植小鼠模型中的兩個不同TGI實驗的匯總觀察數據和模型擬合曲線。表1中描述了兩種細胞系的受體密度和給藥方案的更多詳細信息。所提出的PBPK-PD模型(圖 1C)能夠同時捕獲用磷酸鹽緩沖鹽水(PBS)對照處理的動物的腫瘤生長曲線、未轉導(CAR-) T細胞和抗CD19 CAR-T 細胞,在單次和多次給藥方案下。由于本研究中缺乏CAR-T細胞計數,與“CAR-Target complex”驅動的CAR-T細胞體內擴增相關的參數固定為從抗 BCMA (bb2121) 案例估計的值研究(表 2)。該模型能夠同時表征來自不同研究、異種移植模型和給藥方案的匯總數據集。模型估計的體內腫瘤細胞消耗的最大速率 (KKillmax)和效力(KCCAR-T50)分別估計為0.093(1/h)和18.2(CAR-Target復合物/腫瘤細胞的數量)(列于表 2)。

圖 6. 抗CD19 CAR-T誘導的腫瘤生長抑制的觀察和個體模型擬合曲線。
抗EGFR CAR-T細胞
圖 7描述了在膠質母細胞瘤原位小鼠模型中觀察到的數據集和模型擬合的TGI 曲線,接種了表達EGFR的U87細胞。用PBS對照或1×106個高親和力西妥昔單抗 CAR-T或低親和力尼妥珠單抗CAR-T的CAR+細胞治療動物,通過瘤內(IT)注射以Q1WX3給藥方案給藥。在開發的PBPK模型中,CAR-T細胞的推注劑量被描述為在腫瘤隔室的血管外空間內給藥(圖 1B)。使用PBPK-PD模型同時表征TGI譜使得能夠表征由于EGFR結合親和力對CAR-T細胞的影響而導致的CAR-T細胞的不同功效,證實了 EGFR結合親和力對CAR-T細胞的定量影響在體內環境中的活動。模型估計的體內腫瘤細胞消耗的最大速率(KKillmax)和效力(KCCAR-T50)分別估計為0.032 (1/h) 和 12.4 (CAR-Target 復合物/腫瘤細胞的數量) (列出在表2中)。

圖 7. 抗EGFR CAR-T 誘導的腫瘤生長抑制的觀察和個體模型擬合曲線。用表達 EGFR 的 U87 細胞(第 0 天)接種的顱內異種移植小鼠接受瘤內(IT)給藥(1)
基于模型的模擬研究劑量和腫瘤負荷對腫瘤動力學、靶標參與和CAR-T細胞擴增的影響
為了進一步評估我們開發的PBPK-PD模型的體內相關性,進行了基于模型的模擬以檢查劑量和腫瘤負荷的影響,并將結果與臨床觀察到的結果進行比較。圖 8描述了TGI曲線(圖8A和8D)、腫瘤血管外空間 (VEVTumor) 中“每個腫瘤細胞的 CAR-Target Complexes 數量”(圖 8B 和 8E)以及CAR-T濃度的模型模擬基于bb2121案例研究的模型估計參數。如下所述,模擬結果揭示了一些有趣的趨勢。

圖 8. 使用經過驗證的 PBPK-PD 模型進行模型預測,以同時評估 (1) CAR-T 劑量和 (2) 初始腫瘤負荷對 (A 和 D) 腫瘤生長抑制 (TGI)、(B 和 E) 生成的影響腫瘤血管外空間中“每個腫瘤細胞的 CAR-Target 復合物數量”和(D 和 F)CAR-T 細胞在血液中的擴增:1)CAR-T 劑量:在單次靜脈注射抗 BCMA 后進行模擬( bb2121)攜帶異種移植物的 RPMI-8226 中的 CAR-T 細胞,劑量水平為每只小鼠 0.1、1、5、10 和 5000 萬個 CAR-T 細胞。(2) 初始腫瘤負擔:在初始腫瘤負擔為 50 , 100, 150, 250, 500 和 1000 mm3。
劑量的影響
模擬結果表明,與對照(黑色曲線)相比,在CAR-T達到臨界劑量水平之前,沒有觀察到顯著的TGI。在這個臨界劑量水平之外,有一系列劑量具有陡峭的劑量-暴露關系,然后劑量對暴露的影響趨于穩定(圖 8A)。結果與模擬的“每個腫瘤細胞的CAR-Target復合物數量”一致(圖 8B),即在低劑量水平(紅色和藍色曲線)下,每個腫瘤細胞幾乎沒有形成 CAR-靶標復合物.然而,在更高的劑量水平下,CAR-Target復合物(ECExp50=5.18 復合物/腫瘤細胞)的數量迅速增加,這會同時啟動腫瘤殺傷(圖 8A)和 CAR-T 細胞的擴增(圖 8C)。隨著劑量水平的進一步增加,CAR-Target 復合物的形成速度(圖 8B)以及TGI的速度(圖 8A)增加。這種現象導致腫瘤負荷迅速下降(圖 8A),因此抗原豐度總體下降。隨著腫瘤負荷的下降,由于腫瘤空間內沒有抗原相互作用,CAR-Target Complexes 的總數也迅速下降,導致CAR-T增殖減少。
圖 8C說明了血液隔室內的預期CAR-T動力學。在較低劑量水平下,PK曲線僅限于(藍色和紅色曲線)快速初始分布(到組織),然后是持續消除階段(圖 8C)。然而,在更高的劑量水平下,預計CAR-T細胞會出現劑量依賴性的擴增率。模擬表明,預計CAR-T細胞擴增的總體程度(Cmax)不會超過某些CAR-T劑量水平,而達到Cmax的時間(Tmax)可能會隨著劑量的增加而減少。之后,在抗原耗盡后 CAR-Target Complexes快速減少后,CAR-T細胞的血液PK出現快速收縮階段,隨后是一級消除的持續階段。
?
腫瘤負荷的影響
還評估了基線腫瘤負荷對腫瘤動力學(圖 8D)、每個腫瘤細胞形成CAR-Target復合物(圖 8E)和血液中CAR-T細胞擴增(圖 8F)的潛在影響。有趣的是,模型模擬表明,盡管初始腫瘤負荷存在差異,但CAR-T細胞可以在相似的時間范圍內實現腫瘤消除。這是因為更高的腫瘤負荷導致“每個腫瘤細胞的CAR-Target復合物”(圖 8E)更快但飽和的形成,這固有地導致CAR-T擴展的速率(較低的Tmax)和程度(Cmax)增加(圖 8F)和更快地殺死腫瘤細胞 (圖 8D)。
?
CAR-T細胞PBPK-PD模型的全局敏感性分析
圖 9描述了針對抗BCMA(BB2121)CAR-T細胞(圖 5A,表 2)開發的 PBPK-PD 模型對血液 CAR-T 細胞擴增(圖 9A)和整體腫瘤的全局敏感性分析(GSA)體積(圖 9B)。我們觀察到與“CAR-Target 復合物”形成相關的參數主要對CAR-T細胞的擴增階段敏感(圖 9A)。CAR-affinity(Kon和Koff)、CAR密度和抗原密度等參數與擴增程度呈正相關。GSA關于初始腫瘤負荷和劑量對CAR-T細胞擴增的影響的結果與我們之前的結果非常相似,如圖8所示,其中較高的腫瘤負荷導致較高的 Cmax,而較高的CAR-T劑量導致較短的Tmax。
圖 9B描述了不同參數對腫瘤體積的敏感性。導致更高“CAR-Target復合物”形成的大多數參數(例如CAR-親和力、CAR-密度和抗原密度)與總體腫瘤體積呈負相關。

圖 9. BB2121已開發的PBPK-PD模型的全局敏感性分析結果:基于PRCC的“抗原密度”、“CAR密度”、“CAR-T劑量”、“初始腫瘤負荷”、“Koff”的敏感性指標’ 和 ‘Kon’ 在 (A) 血液 CAR-T 濃度和 (B) 總腫瘤體積
討論
用 CAR 轉導的 T 細胞的過繼細胞轉移已經徹底改變了臨床免疫治療領域。這些“自我復制劑”在對血液系統惡性腫瘤患者給藥后顯示出顯著的臨床療效和長期持久性。這些藥物的有前景的屬性已得到監管機構的認可,2017 年,兩種 CAR-T 細胞療法獲得了美國食品和藥物管理局的批準。盡管取得了巨大成功,但關鍵藥物特異性和系統性的定量影響臨床中與 CAR-T 細胞活性相關的特定決定因素尚不清楚。為 CAR-T 細胞建立 PK-PD 關系具有挑戰性,并且沒有既定的范式或指南來預測人體 CAR-T 細胞的安全有效劑量水平。開發多尺度系統 PK-PD 模型可能是確定與這些藥物的動力學和活性相關的關鍵決定因素的非常有益的第一步。
Stein等人最近使用來自tisagenlecleucel(抗 CD19)臨床試驗的2期數據集提交了第一份關于CAR-T細胞臨床PK表征的報告。該模型將血液循環中的CAR-T細胞動力學分為三個不同的階段:(1)初始時間受限的指數擴張階段,隨后是(2)快速收縮階段,然后是(3)持續持續階段。該模型成功地捕獲了人類獨特的CAR-T動力學曲線,并估計了CAR-T動力學每個不同階段的斜率。然而,該模型的描述性限制了對其他CAR-T細胞療法和替代劑量水平的外推。
最近,Hardiansyah等人采用了一種更系統的方法來表征臨床CAR-T細胞PK和細胞因子釋放動力學,他們利用腫瘤動力學來驅動CAR-T細胞擴增以及效應器和記憶 T 細胞之間的相互轉換表型。該模型對不同的CAR-T細胞分布動力學的潛在機制提供了一些見解,并突出了CAR-T動力學和PD的綜合性質。盡管他們最初的數據分析僅限于兩名患者,在參數估計中觀察到較大的受試者間變異性,但它證明了使用基于機制的模型來捕獲CAR-T細胞動力學的可行性,即時間-依賴擴張,快速收縮和持久的持久性。
在這里,我們使用了一種基于機制的自下而上的方法來量化與CAR-T細胞活性和獨特的CAR-T細胞PK行為相關的關鍵藥物和系統特定參數的影響。我們建模方法的第一步涉及開發細胞級PD模型(圖 1A),該模型考慮了CAR親和力、CAR密度、抗原密度和E:T比率的影響,以計算“每個腫瘤細胞的CAR靶標復合物,因此決定了可飽和腫瘤細胞殺傷、CAR-T 擴增和細胞因子釋放的速率和程度。使用來自一組綜合體外實驗的報告數據(如表 1 所述),該模型解釋了動態E:T比率(由于T細胞擴增)、關鍵藥物特異性(例如,CAR-親和力和 CAR-密度)以及系統特異性(例如抗原密度)決定因素,同時估計關鍵效力參數。開發的細胞水平模型被證明可以定量捕捉一些藥物特異性參數(如CAR親和力和CAR密度)對體外整體CAR-T細胞活性的影響。
事實上,最近對CD19 CAR-T、CAT19的臨床觀察表明,與tisagenlecleucel (FMC63)相比,它具有較低的親和力(更快的Koff率),因此具有更好的體外流動性,已證明具有更好的耐受性(即更低的在CARPALL臨床試驗中,與tisagenlecleucel (KYMRIAH?) 相比,同時保留了臨床療效的程度。在為 CAR-T 細胞開發轉化體內PK-PD關系時,此類臨床觀察進一步強化了我們整合細胞水平信息的方法。我們設想未來將使用這種細胞級模型來識別最佳CAR-T 特征(即 CAR-親和力和 CAR-密度),并促進在發現階段選擇領先的CAR-T候選者。
我們建模分析的第二步是開發一個PBPK模型來表征CAR-T細胞的全身分布。為 CAR-T開發PBPK模型至關重要,因為許多文獻報道表明,預計總淋巴細胞群中只有一小部分(~2%)存在于外周血中。由于大多數抗原豐度(腫瘤對于開發中的 CAR-T 細胞的負載)通常位于骨髓、脾臟、淋巴結(血液學靶點)或實體瘤中,因此必須有一個強大的生理框架來表征血液:CAR-T 細胞的組織關系。
所提出的 PBPK 模型(圖1B)結構基于Baxter等人和Khot 人發表的工作,用于表征CAR-T細胞的生物分布。該模型假設:(1)T細胞消除器官是肝臟,基于支持這一觀點的多篇文獻報道,和(2)CAR和腫瘤抗原僅在異種移植小鼠模型的腫瘤室內相互作用。PBPK模型能夠同時表征所有主要感興趣組織中未轉導的 T 細胞、抗EGFR CAR-T細胞和抗CD19 CAR-T細胞的生物分布。脾臟、肝臟和肺被確定為 CAR-T 細胞生物分布最大的器官(當比較Jorgan值時),這與之前在異種移植小鼠和患者中的許多研究一致。
我們建模分析的第三步也是最后一步是建立一個整合的PBPK-PD關系,這同時解釋了腫瘤結合和旁通未結合的CAR-T細胞的擴增,以及體內的抗腫瘤反應(圖 1C)。該模型能夠表征血液中抗 BCMA CAR-T 細胞的快速擴增階段并觀察到 TGI(圖 5A)。該模型后來被用于表征 TGI 數據集:(1)親和力變體抗 HER2 CAR-T(圖 5B),(2)抗 CD19 CAR-T(圖 6)和(3)抗 EGFR CAR -T(圖 7)細胞。當在臨床前環境中對先導 CAR 結構進行分類時,我們的轉化建模框架可用于建立體外-體內相關性。基于不同 CAR 構建體的效力參數的總體比較(列于表 1),我們觀察到體外效力值的等級排序可以轉化為體內設置,并且體外效力值始終保持在 ~10 到 20比體內效力值高一倍(KCCAR-T50 較低,表 2)。與動態的體內情景相比,這一觀察結果可能是由于 CAR-T 細胞在靜態體外共培養環境中與腫瘤細胞接觸的可能性更高。
最后,通過評估(1)劑量和(2)初始腫瘤負荷對CAR-Target復合物形成、抗腫瘤反應和CAR-T細胞在血液中擴增的影響,檢查了開發的PBPK-PD模型的體內相關性(圖 8)并將模擬與人類報告的CAR-T曲線進行比較。模型模擬表明,在形成閾值“每個腫瘤細胞的CAR-Target 復合物”后,CAR-T細胞會加速擴增(圖 8C 和 8F),從而加速腫瘤細胞的根除(圖 8A 和 8D) .在具有多個CAR-T計劃(例如,抗CD19和抗BCMA CAR-T)的臨床環境中觀察到了類似的模式,其中在 CAR-T 細胞擴增時,在體內觀察到快速的腫瘤耗竭2-3個月,完全響應率很高。血液 PK 的模型模擬(圖 8C和8F)還顯示,在靜脈注射CAR-T細胞后,血液PK開始迅速下降,可能是由于分布到其他組織(快速分布階段)。然而,一旦CAR-T細胞在作用部位(生物相)內擴增,它們就會再循環回血流中。在所有臨床試驗結果(例如tisagenlecleucel)中,血流中CAR-T細胞擴增階段開始的延遲很普遍,尤其是在早期時間點(例如1-2個月)報告PK數據的情況下。模擬還表明,在總體腫瘤負荷耗盡后,CAR-Target復合物形成的數量減少(圖 8B和8E),這導致CAR-T的血液 PK 內出現快速收縮階段(圖8C和8F),在剩余的 CAR-T 細胞進入一個延長的持續階段之前,一級消除。這組模擬(圖 8C 和 8F)與臨床中 CAR-T 細胞動力學的典型趨勢一致。
我們的模型模擬還表明了一個非常陡峭的 CAR-T 劑量-暴露關系(圖 8C),然后是一個平臺期。觀察到的平臺受限于“每個腫瘤細胞的CAR-Target復合物數量”的飽和形成(圖 8B 和 8E)。這一觀察結果與許多臨床PK數據集一致,其中超過一定水平的劑量不再與觀察到的 Cmax 相關。最近來自抗BCMA (bb2121) 1 期研究的臨床PK數據集也揭示了陡峭的劑量暴露關系,其中超過閾值劑量(1.5 億 CAR-T 細胞),所有隨后的更高劑量水平產生非常相似的Cmax水平。在研究中,細胞因子釋放綜合征的發生也與暴露程度相關,因此高于閾值劑量。然而,擴展至 Cmax 的速率隨著劑量水平的增加而增加(圖 6B)。這在一些報道的抗 CD1936、37 和抗BCMA CAR-T細胞的臨床PK 數據中觀察到,其中注入更高劑量 CAR-T 細胞的患者實現更快的擴增至 Cmax(即更低的 Tmax)。模型模擬還揭示了患者腫瘤負荷的影響,這可能導致 CAR-T細胞暴露(包括 Cmax)的顯著變化。這也與許多臨床報告一致(針對抗CD19 CAR-T),其中較高的腫瘤負荷導致較高的 Cmax,因此更多的細胞因子釋放。
總而言之,我們在這里描述了一種基于機制的模型,用于表征CAR-T細胞的 PK-PD。盡管需要進一步發展的模型來通過結合其他相關成分來描述 CAR-T 細胞的臨床行為,例如CAR-T細胞記憶分化的動力學、CD4/CD8比率和細胞因子環境對體內擴增的影響CAR-T 細胞是我們的多尺度轉化 PBPK-PD 模型,整合了藥物和系統特異性參數,能夠在體外和體內表征CAR-T細胞活性。與CAR-T細胞的不同亞群(CD4+與CD8+)和表型(干細胞記憶[Tscm]與效應T細胞[Te])相關的基于流式細胞術的測量的可用性將使我們的基礎模型進一步發展,以解釋差異擴張體內不同CAR-T細胞表型的能力和效力。盡管如此,我們目前的模型有望為理解 CAR-T 細胞的臨床行為提供一個框架,從而促進未來 CAR-T 細胞療法的設計和開發。


D
O
i
:
Development of a quantitative relationship between CAR-affinity, antigen abundance, tumor cell depletion and CAR-T cell expansion using a multiscale systems PK-PD model
https://doi.org/10.1080/19420862.2019.1688616
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/9689.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃