實體瘤是在復雜的腫瘤微環境中發生和發展的,高水平的腫瘤浸潤淋巴細胞(TIL)通常與良好的預后結果相關。然而,效應T(Teff)細胞可能暴露于來自TME的免疫調節信號和可影響轉錄和表觀遺傳的連續抗原刺激。這種暴露會限制其活性,并導致一種稱為T細胞耗竭的功能障礙。
Teff細胞功能障礙包括多種T細胞特征,如分化和細胞溶解特性改變,增殖和死亡程序失調以及多種免疫抑制信號(如PD-1、LAG-3、TIM-3、TIGIT和CD39)的表達增加。最近的研究利用單細胞策略探討了人類黑色素瘤和肺癌中腫瘤抗原特異性效應T細胞的功能特性和臨床意義。這些發現擴大了我們對腫瘤微環境中T細胞改變的理解,并證明CD8+T細胞耗竭是通過暴露于腫瘤細胞特異性抗原介導的,并且與組織駐留記憶表型相關。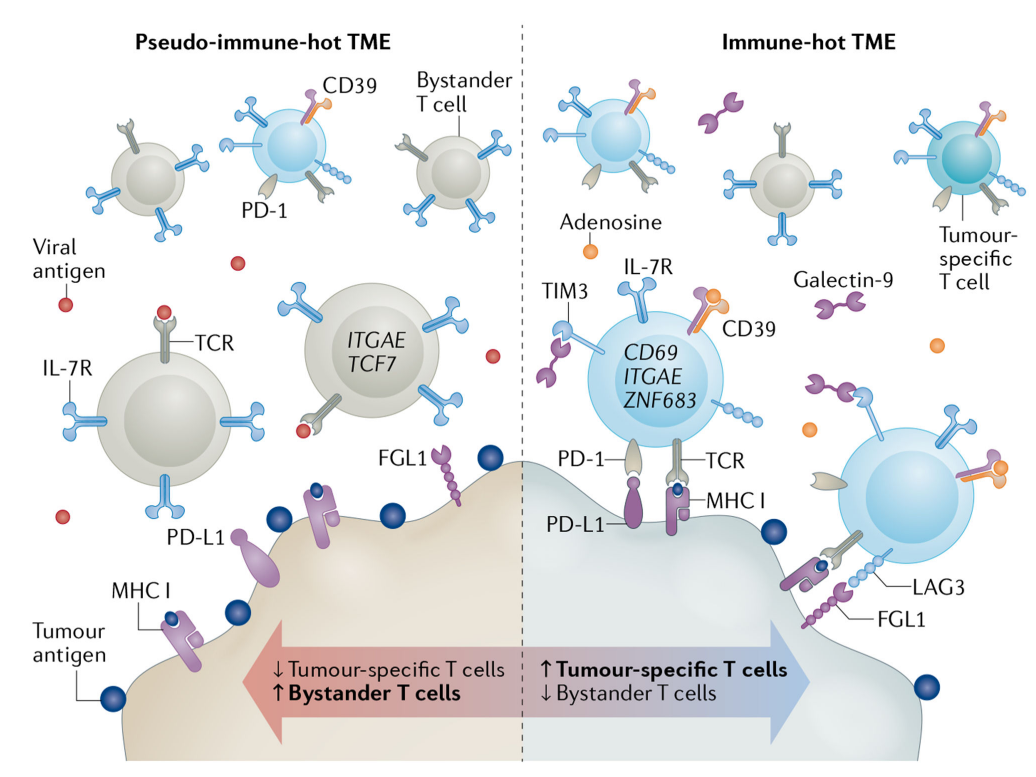
一項研究評估了四名手術切除黑色素瘤患者的腫瘤抗原特異性CD8+Teff TIL中的單細胞轉錄譜、T細胞受體(TCR)庫和選定的表面蛋白。根據優勢Teff克隆型的分布,最終將其分為兩個功能類別:耗竭細胞和非耗竭記憶細胞。擴增最多的TCR克隆型的CD8+Teff細胞主要具有耗竭的特征,并表達與組織駐留記憶(TRM)細胞相關的轉錄物,例如ITGAE(編碼CD103)和ZNF683。
此外,當導入無癌個體的T細胞時,大多數(83%)來自耗竭的CD8+Teff細胞的TCR克隆對癌細胞具有自體反應性,而來自未耗竭細胞的TCR只有10%具有反應性。大多數從TIL分離的TCR識別一種或多種具有共同HLA限制的腫瘤特異性抗原。在一項研究的14例黑色素瘤患者中,初始外周血樣本中耗竭的腫瘤抗原特異性CD8+Teff細胞很少見,但在ICIs治療后進展的患者中可以檢測到更多的此類細胞,這些耗竭的細胞特征性地表達高水平的PD-1和CD39。
總之,這些結果表明,腫瘤抗原特異性Teff細胞具有耗竭的功能特征,這種狀態的獲得是由持續暴露于腫瘤抗原驅動的。這些結果與之前的研究一致,表明腫瘤抗原特異性與其他惡性腫瘤患者TIL中的Teff細胞耗竭密切相關。盡管這些研究也報告高豐度的未耗竭病毒特異性旁觀者T細胞,但似乎對抗腫瘤反應沒有貢獻。
另一項研究分析了20例經nivolumab新輔助治療的非小細胞肺癌患者的體外擴增腫瘤抗原特異性CD8+Teff細胞的單細胞轉錄組學特征和TCR序列。基于轉錄組學分析,共鑒定出15個T細胞簇,其中6個具有與TRM細胞一致的表達譜。大多數新抗原特異性CD8+Teff細胞克隆型被分配到不同的TRM細胞簇,其特征是效應功能不完整、免疫抑制信號增加、TRM標記物上調以及與T細胞耗竭相關的轉錄因子表達增加(PRDM1和TOX2)。這些特征在病毒特異性旁觀者T細胞中未觀察到。
總之,以上這些研究表明腫瘤抗原特異性細胞顯示TRM表型,并顯示耗竭或功能失調的特征。此外,與病毒特異性T細胞相比,新抗原特異性CD8+Teff細胞也降低了IL-7R的表達和對IL-7刺激的敏感性。這些研究擴大了我們對免疫“熱”腫瘤中T細胞改變的理解,它們明確證明了CD8+Teff細胞耗竭是通過暴露于腫瘤細胞抗原介導的,并且與TRM表型顯著相關。這些研究還證明存在不同水平的未耗竭旁觀者細胞,其腫瘤反應性有限,生物功能不明確。大量的這些旁觀者細胞的存在可能會產生假免疫“熱”腫瘤,并降低對ICIs治療的敏感性。
減少或控制TME中T細胞功能障礙的負面影響的可能治療選擇包括使用同時針對多個共同抑制信號或受體的聯合療法,使用基因修飾(例如,抗耗竭)的腫瘤抗原特異性T細胞的過繼性細胞療法,或調節IL-7途徑。未來還需要進一步的研究,以確認這些發現的臨床意義,擴大對TRM細胞在ICIs反應中作用的理解,并揭示腫瘤特異性T細胞功能失調的具體分子機制。
參考文獻:
1.?Tumour antigen-induced T cell exhaustion —
the archenemy of immune-hot malignancies. Nat Rev Clin Oncol. 2021 Dec; 18(12):
749–750.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/15226.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃