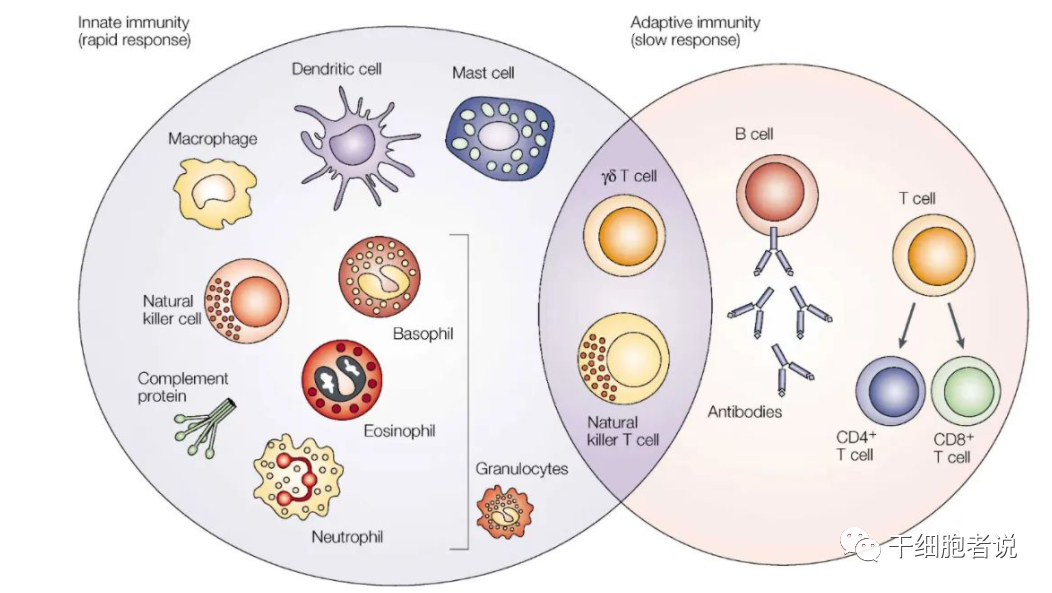
NK細胞來源和供體選擇
NK細胞發現于20世紀70年代,主要與殺死感染的微生物和惡性轉化的同種異體和自體細胞有關。在人體內,NK細胞來源于CD34+共淋巴祖細胞。據估計,NK細胞的半衰期大約為7~10天,它們通過與DC細胞的相互作用發揮關鍵的免疫調節功能。
?
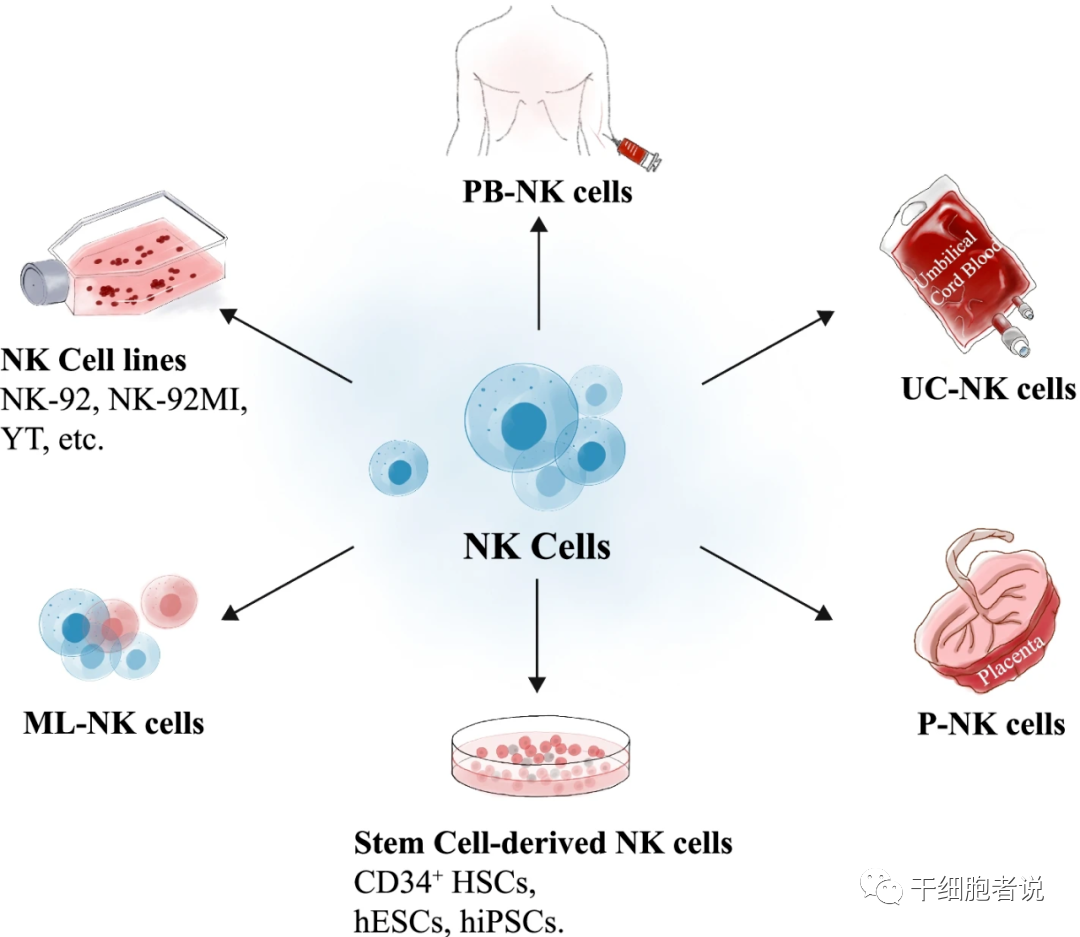
NK細胞的來源廣泛,包括外周血、臍帶血、多能干細胞(ESC和 iPSC)和NK細胞系(如NK92細胞系等)?。所有來源都可以提供具有臨床意義的細胞劑量,適合制備CAR-NK,并已過渡到人體研究。每個來源都有優點和潛在的挑戰。CAR–NK細胞已成功從包括臍帶血在內的不同平臺進行工程設計。
▉?外周血或臍帶血來源
原代NK細胞可以從外周血(PB-NK細胞)中收獲或來自臍帶血(CB-NK細胞)。PB-NK細胞,是2005年由Dario Campana領導的首次成功將CAR構建體遞送到NK細胞中的平臺。PB-NK細胞為目前正在臨床試驗的各種產品提供了基礎材料。
?
▉?誘導多能干細胞來源
iPSC是NK細胞的一個的來源,iPSCs可高效擴增,還能體外分化。通過iPSC可以制造大量遺傳背景一致的NK細胞產品。iPSC的制備需要種子細胞少,可大量培養,成本較低,可實現自體供給,免疫原性較低。
?
iPSC來源的NK細胞有兩個缺點,第一,表達低水平的CD16。第二,iPSC可能含有“表觀遺傳記憶”,而這可能會影響與供體細胞不同的特定細胞譜系的發育。
?
▉?NK細胞系來源
NK-92是第一個獲得美國FDA批準進行臨床試驗的NK細胞,是一種均勻的、永生的NK淋巴瘤細胞系,可以離體擴增。NK-92細胞缺乏大多數KIRs的表達,因此不太可能被抑制。
?
然而,在患者給藥之前需要照射NK-92衍生的細胞產物,這影響體內的長期持久性和整體性治療潛力。另一個缺點是,由于缺乏CD16表達,NK-92細胞缺乏通過ADCC介導細胞殺傷的能力。

圖3 不同來源的NK細胞的優點和局限
–02–
如何增強NK細胞功能

CARs是合成的融合蛋白,包括細胞外抗原識別域和觸發細胞活化的細胞內信號傳導部分。CARs可以在免疫效應細胞上表達,以重新編程其對特定靶點的特異性。CAR-T細胞療法是第一個出現的。此后,傳統上為T細胞設計的CAR已被用于CAR-NK細胞的產生,研究表明這些細胞可以靶向特異性腫瘤,同時保持理想的安全性。細胞內抗原以肽-HLA復合物的形式存在,通過TCR檢測。工程NK細胞表達TCR可以檢測這種肽。TCR-NK細胞,被證明可以引發抗腫瘤反應。
▉?NK細胞銜接器
NK細胞銜接器,可以將NK細引導到腫瘤部位,通過觸發NK細胞上的激活受體來引發強烈的抗腫瘤反應,同時結合腫瘤細胞上的目標抗原。開發策略包括三個特異性或四個特異性設計,靶向腫瘤上的多種抗原,或通過交聯細胞因子部分,促進NK擴增和存活,旨在增強抗腫瘤作用。細胞銜接器的使用,因此代表了一種更簡單,成本更低的制造工藝,來提供能夠誘導CAR樣活性的產品。
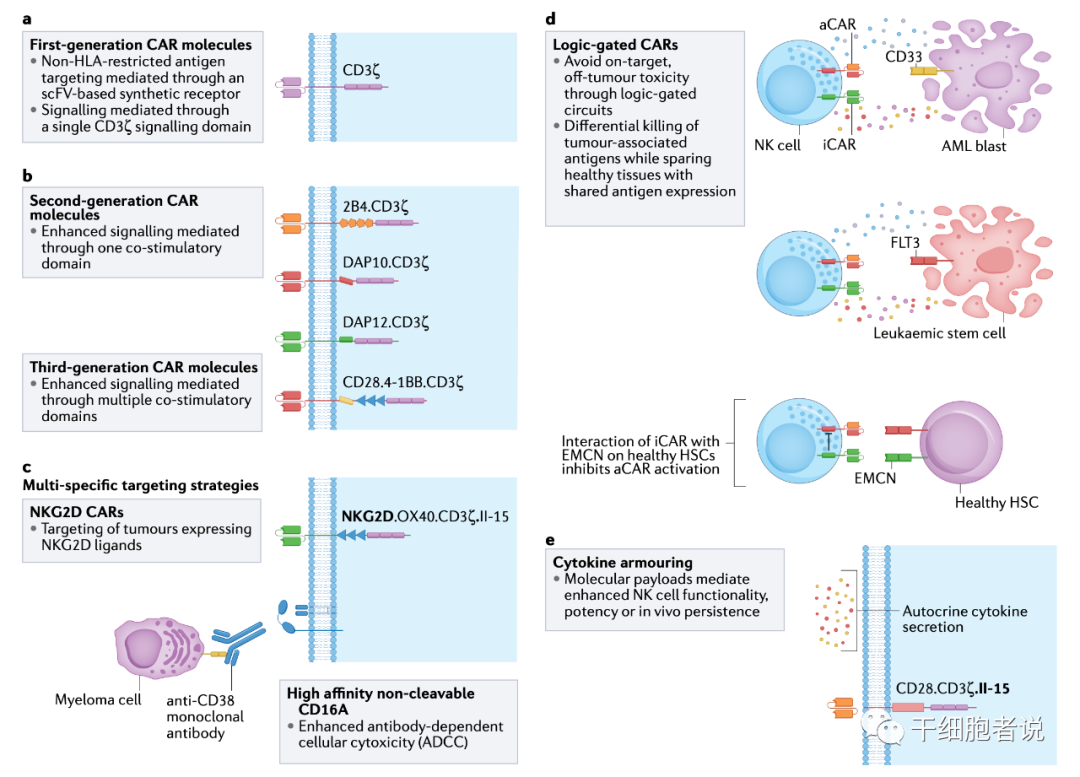
圖4 CAR設計的原則和策略
-
改變腫瘤的代謝構成或修改免疫細胞中的基因表達程序,以保護它們免受TME中抑制性代謝物的侵害; -
通過小分子抑制劑或拮抗抗體阻斷腫瘤細胞上的CD73克服腺苷介導的免疫抑制。
臨床研究表明,NK細胞在治療血液系統惡性腫瘤方面具有安全性和有效性。重要的是,無論采用哪種方法,NK細胞療法都一直顯示出良好的安全性。迄今為止,沒有觀察到CRS或GVHD。然而,大多數報道的成功僅限于血液系統惡性腫瘤,并非所有患者都對NK細胞治療有反應,有些患者最終會復發。
無論如何,CAR-NK 細胞療法是一個很有前途的臨床研究領域,對某些癌癥患者具有良好的安全性和初步療效。相信,CAR-NK細胞療法可能會導致腫瘤免疫治療的革命性進展。
Rezvani
參考資料:
[1] Laskowski, T.J., Biederst?dt, A. & Rezvani, K. Natural killer cells in antitumour adoptive cell immunotherapy.Nat Rev Cancer?(2022).?
[2] Maskalenko et al.,?Harnessing natural killer cells for cancer immunotherapy: dispatching the first responders.?Nature Reviews Drug Discovery,??(2022).
[3] Le Saux and Schvartzman?Advanced Materials and Devices for the Regulation and Study of NK Cells.?Int. J. Mol. Sci.,??(2019).
[4] Zhang et al.,. CAR-NK cells for cancer immunotherapy: from bench to bedside.?Biomarker Research,(2022)
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/18714.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃