繼CARVYKTI??(西達(dá)基奧侖賽,英文通用名Ciltacabtagene Autoleucel,簡稱Cilta-cel)在治療復(fù)發(fā)或難治性多發(fā)性骨髓瘤領(lǐng)域獲批之后,傳奇生物在實體瘤研發(fā)領(lǐng)域再傳好消息。
金斯瑞生物科技公司(01548.HK)非全資附屬公司傳奇生物科技股份有限公司宣布,美國食品和藥物管理局已批準(zhǔn)其新藥LB1908臨床試驗(IND)申請,以評估其在美國的I期臨床試驗。

圖注:傳奇生物公司關(guān)于FDA批準(zhǔn)LB1908Ⅰ期臨床試驗公告
公告稱,LB1908是在研的自體嵌合抗原受體T細(xì)胞療法(“CAR-T療法”),通過高親和力VHH抗體選擇性靶向Claudin18.2,用于治療復(fù)發(fā)性或難治性胃癌、食管癌(包括胃食管連接部)或胰腺癌成人患者。Claudin18.2是一種在上述癌癥亞型患者中均表達(dá)的緊密連接蛋白。
這項I期、首次人體、開放標(biāo)簽、多中心臨床研究旨在評估LB1908的安全性和耐受性,并確定II期的推薦劑量,評估其初步療效。該研究將分為劑量遞增和劑量擴(kuò)大階段。入組的患者必須Claudin18.2高表達(dá)。
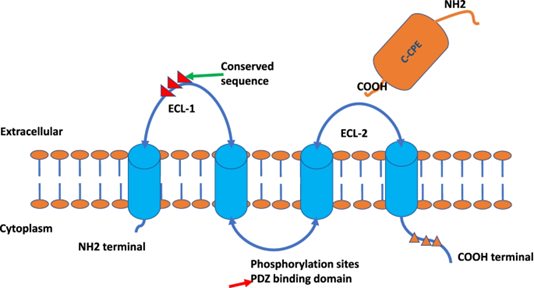
圖注:Claudin 蛋白結(jié)構(gòu)的描述。具有兩個細(xì)胞外環(huán) (ECL)、ECL-1 和 ECL-2 的四個跨膜結(jié)構(gòu)域 [1]
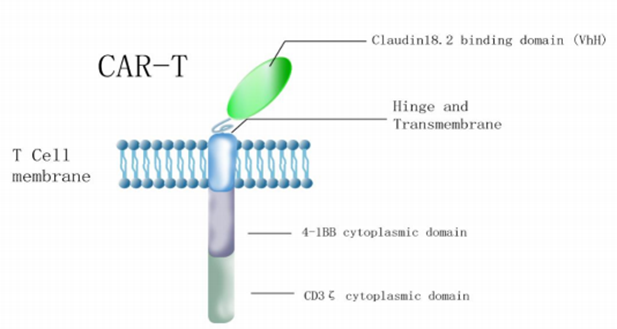
圖注:LB1908 CAR-T結(jié)構(gòu)示意圖(來源于傳奇生物官網(wǎng))
LB1908的特點:
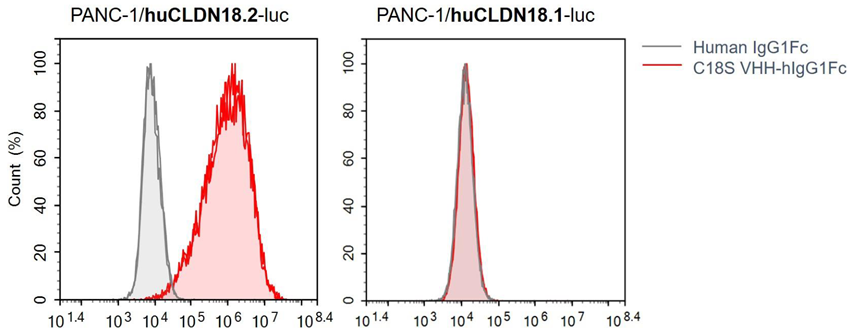
①高特異性靶向Claudin18.2,而不靶向Claudin18.1(Claudin 18.1在人肺組織(肺泡細(xì)胞)中度表達(dá))
②在胃腫瘤/胰腺腫瘤CDX小鼠模型中顯示出極佳的治療效果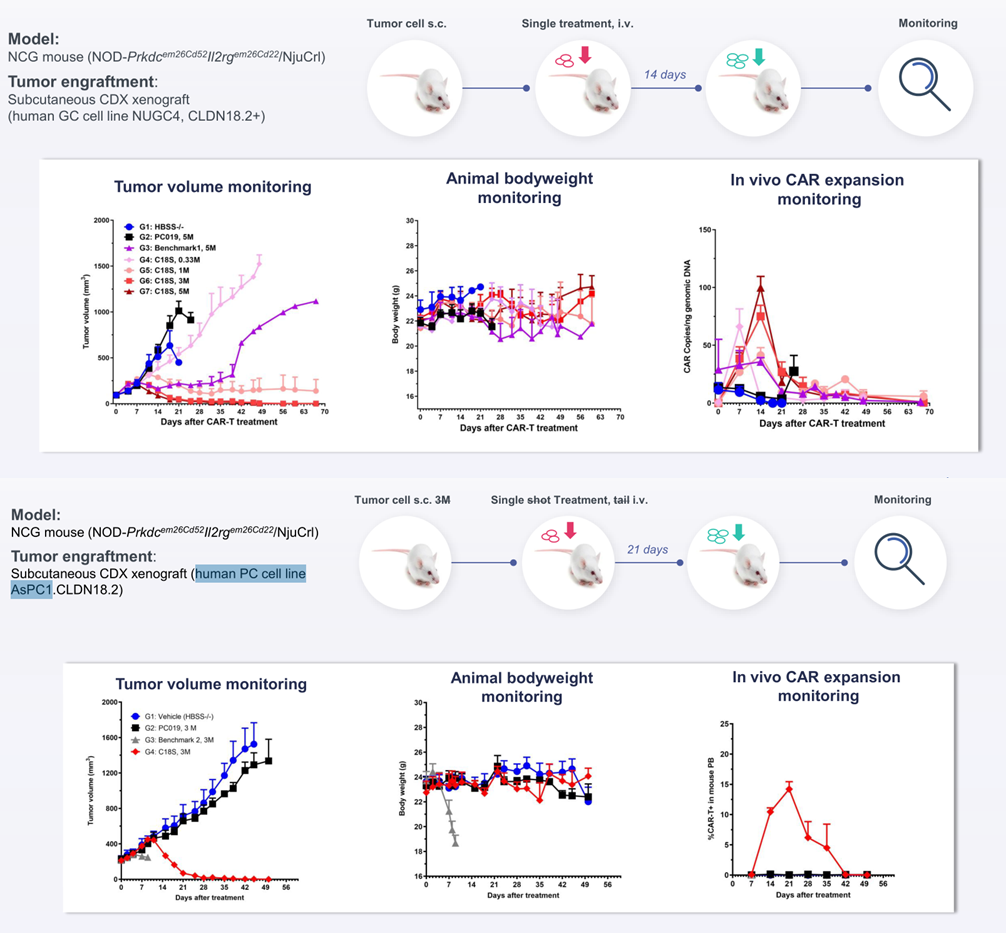
一項由研究者發(fā)起的評估LB1908治療晚期胃癌的I期臨床試驗在中國同步進(jìn)行(NCT04467853)。
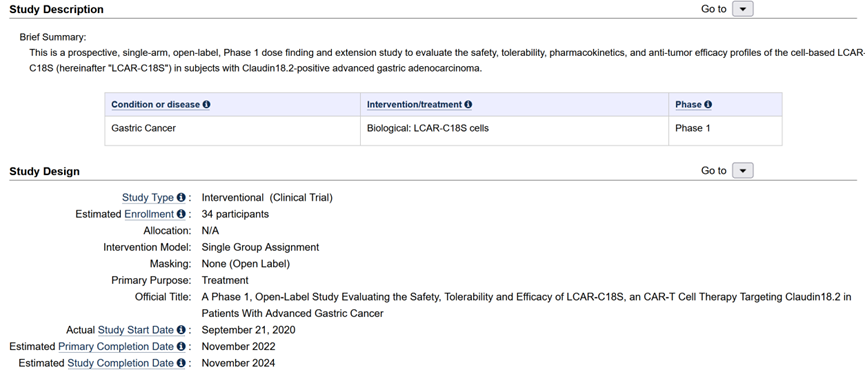
圖注:NCT04467853臨床試驗詳細(xì)信息

圖注:傳奇生物公司研發(fā)管線
參考資料:
[1]Cao W, Xing H, Li Y, Tian W, Song Y, Jiang Z, Yu J. Claudin18.2 is a novel
molecular biomarker for tumor-targeted immunotherapy. Biomark Res. 2022 May
31;10(1):38.
[2]傳奇生物公司官網(wǎng)
編輯:小果果,轉(zhuǎn)載請注明出處:http://www.448371.com/cells/myxb/14168.html
免責(zé)聲明:本站所轉(zhuǎn)載文章來源于其他平臺,主要目的在于分享行業(yè)相關(guān)知識,傳遞當(dāng)前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請及時告知,我們會在24小時內(nèi)刪除相關(guān)信息。
說明:本站所發(fā)布的案例均摘錄于文獻(xiàn),僅用于科普干細(xì)胞與再生醫(yī)學(xué)相關(guān)知識,不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃