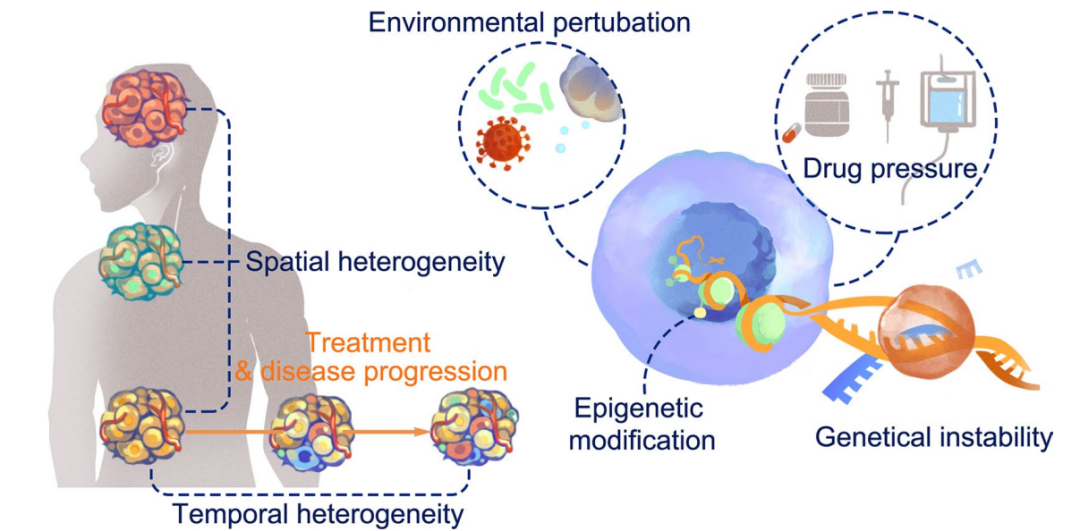
在腫瘤發生和隨后的轉移過程中,惡性細胞逐漸多樣化,變得更具異質性。因此,腫瘤可能被多種免疫相關成分浸潤,包括細胞因子/趨化因子環境、細胞毒性活性或免疫抑制因子。這種免疫異質性在幾乎所有實體瘤中普遍存在,并且隨著腫瘤的發展以及治療干預而在空間上或時間上發生變化。抗腫瘤免疫的異質性與疾病的進展和治療的反應性密切相關,尤其是在免疫治療領域。
因此,準確了解腫瘤免疫異質性對于有效治療的發展至關重要。在多區域和組學測序、單細胞測序以及縱向液體活檢方法的幫助下,最近的研究顯示了研究腫瘤免疫異質性的復雜性及其在免疫治療中臨床相關性的潛力。探索腫瘤免疫微環境異質性的機制,有助于我們對腫瘤異質性的臨床評估,從而促進更有效的個性化治療的發展。
遺傳不穩定性
高通量測序方法長期以來一直被用來描述腫瘤細胞的突變譜和進化軌跡,這些研究在時空維度上描繪了廣泛的遺傳腫瘤異質性,包括異質性單核苷酸突變、插入、缺失和拷貝數突變。在腫瘤進展過程中,遺傳不穩定性導致隨機產生這些改變。
在原發性腫瘤中,受驅動基因的突變通常會帶來生存優勢;因此,這些細胞更有可能占據生長優勢的位置,并發展成為優勢克隆群體。相比之下,乘客突變在腫瘤進化過程中不會帶來顯著的生長優勢,它們被認為是亞克隆腫瘤細胞的主要來源。因此,起源于克隆和亞克隆腫瘤細胞的遺傳不穩定性構成了腫瘤進化和時空異質性的基礎。同時,這種基因異質性塑造了腫瘤的抗原譜,并最終促成了腫瘤免疫微環境的異質性。
表觀遺傳修飾
越來越多的證據表明,腫瘤細胞的表觀遺傳重塑也參與了異質性腫瘤免疫微環境的形成。這種調節機制主要歸因于DNA修飾的改變、染色質可及性的改變或轉錄后水平上的基因表達調節,如非編碼RNA干擾。這些表觀遺傳修飾促進了腫瘤細胞的惡性進展,并有助于形成腫瘤免疫微環境。
除了甲基化之外,各種染色質和表觀遺傳重塑機制賦予腫瘤細胞適應周圍環境的優勢。通常,表觀遺傳修飾是有條件可逆的。在腫瘤細胞中,這些修飾可以由其后代遺傳,因此,這些細胞在空間和縱向維度上表現出顯著的異質性。
微環境擾動適應度
腫瘤細胞持續暴露于細胞外微環境擾動中。越來越多的證據表明,細胞內適應性可由外部應激引起,包括DNA損傷反應、未折疊蛋白質反應和線粒體應激信號。腫瘤在組織學和血管構筑方面表現出顯著的異質性。
腫瘤內血管近端或遠端的區域可能暴露于不同的氧氣供應。因此,免疫成分能夠以時空異質的方式適應基于氧氣張力、葡萄糖可用性或氧化途徑的外部刺激。無論免疫組分在缺氧條件下是否適應良好,幾乎所有的缺氧反應都與腫瘤免疫微環境的重編程密切相關,其主要特征是細胞糖酵解代謝的局部轉換、葡萄糖消耗增加、丙酮酸和乳酸產生增加,和酸化。
抗腫瘤治療的反應
在治療過程中,微環境中的腫瘤細胞和所有免疫成分要么被打擊(如放療),要么持續暴露于抗腫瘤藥物。為了應對這些應激因素,腫瘤和免疫細胞的適應性機制被啟動,以建立新的內環境平衡。
由于驅動突變或分子特征的內在異質性,腫瘤細胞對治療的反應性存在顯著差異。細胞毒性條件使腫瘤和免疫細胞經歷表型改變、細胞衰老甚至細胞死亡。無法在治療中存活的局部腫瘤克隆通過自噬介導的細胞死亡釋放大量ATP。這些ATP可以促進趨化作用,并在腫瘤中產生炎癥反應。相反,在存在細胞外核苷酸酶的情況下,ATPs可以在細胞外基質中迅速轉化為腺苷,從而形成抑制性免疫微環境。
對于免疫細胞而言,T細胞表型在對ICI的反應中發生顯著變化,伴隨著不同的T細胞亞群組成和細胞因子產生。治療藥物、腫瘤細胞和免疫細胞之間復雜而動態的相互作用顯著促進了時空異質免疫微環境的形成。
空間異質性
腫瘤免疫微環境的特征主要由腫瘤和非腫瘤成分決定。它們的定位或豐度/活性在空間上是不同的,包括抑制性免疫檢查點(如PD-L1)的表面表達、免疫抑制或促炎細胞因子的分泌、免疫抑制或效應細胞的浸潤、血管系統的狀態、邊緣區域的空間距離,以及代謝營養素的分布。這些空間變異也會對臨床預后和治療反應產生深遠影響。
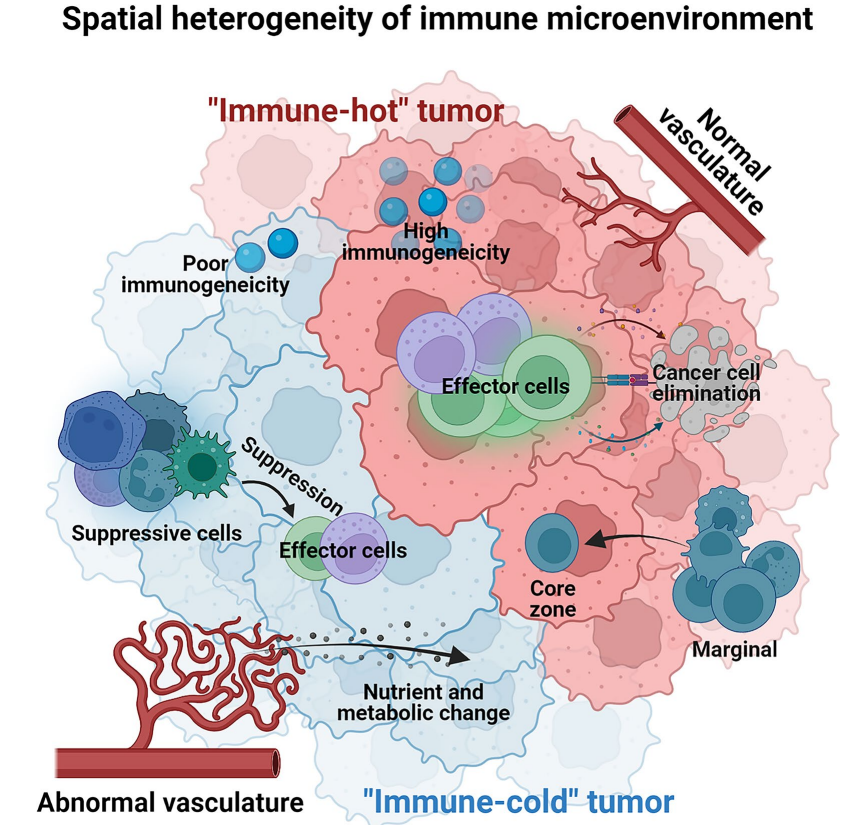
腫瘤內T細胞的表型表現出顯著的異質性。T細胞通常具有不同的克隆性、增殖潛能、分化階段、功能極化、細胞因子分泌譜或代謝環境。關于T細胞庫的傾向性,擴增/增殖性T細胞受體(TCR)可進一步分為常見TCR克隆(在腫瘤內所有區域檢測到)或區域克隆(異質分布)。常見和區域性TCR克隆的數量與常見和區域性非同義突變的負荷呈正相關,表明區域異質性、抗原驅動的T細胞增殖。此外,值得注意的是,調節性T細胞(Treg)也顯示出顯著的腫瘤內空間異質性和功能取向。
除了T細胞亞群,在各種腫瘤類型中也發現了許多其它免疫細胞的腫瘤內異質性。在胃癌中,CD68+CD163+CD206+表型的巨噬細胞主要位于基質中,與邊緣區相比,CD68+IRF8+巨噬細胞在核心區過表達。除了免疫細胞群,基質細胞(如成纖維細胞)在腫瘤中也表現出高度的空間取向性。
代謝譜是免疫微環境的重要調節因子,可能通過影響癌細胞的增殖潛能和適應環境而發揮作用。代謝特征的異質性似乎有助于腫瘤免疫微環境的異質性。具有高糖酵解活性的惡性細胞不僅可以將其代謝途徑轉變為合成代謝反應,還可以產生大量免疫抑制介質,如乳酸和腺苷,以減弱細胞毒性細胞的免疫監視。
時間異質性
腫瘤和免疫細胞很容易被遺傳或非遺傳環境因素干擾,因此決定了疾病的進展和對抗腫瘤治療的反應,以及腫瘤細胞本身的動態進化。在疾病從非侵襲性病變發展為侵襲性表型的過程中,胰腺導管腺癌患者的RNA-Seq揭示了免疫細胞浸潤成分的顯著變化。通常表現為CD8+T細胞和樹突狀細胞的浸潤減少,以及免疫抑制細胞(包括Treg、MDSC或CAF)的異常聚集或擴增。
此外,多種腫瘤類型的疾病進展過程中,還存在細胞溶解活性受損、細胞庫擴展和克隆性受限以及T細胞和B細胞的進行性衰竭。個體患者中免疫不利區域或病變的出現似乎與疾病控制和生存預后成反比,這進一步加強了時空異質性對疾病結果的重要性。
幾乎所有癌癥患者的免疫預后或預測性生物標志物都是基于對單個活檢樣本的分析而建立的。然而,異質性是研究重現性的一個重大障礙,并削弱了其臨床實用性。此外,大量證據表明,腫瘤微環境的異質性,無論是遺傳的還是免疫的,都會影響實體瘤患者的免疫治療效果。
PD-L1表達的異質性
自從第一個證據支持PD-L1蛋白表達和抗PD-1檢查點阻斷療法的療效相關以來,PD-L1水平已被用作伴隨診斷,以預測各種實體瘤類型對ICI免疫療法的臨床反應。然而,無論在腫瘤內或腫瘤間尺度上,還是在空間和時間維度都存在顯著的異質性PD-L1表達。
在評估來自NSCLC患者的原發性和腦轉移腫瘤中PD-L1的表達后,可以觀察到兩種病變之間PD-L1表達存在顯著差異。PD-L1表達是由IFN-γ信號通路強烈誘導的,該信號通路在含有功能異常JAK1/2突變的亞克隆中受到異質性調控。此外,在接受ICI治療的患者中出現的抗原處理和呈遞缺陷亞克隆與黑色素瘤、肺癌和結直腸癌的不良臨床結果相關。這種潛在的異質性可以解釋為什么一部分PD-L1陽性腫瘤患者沒有反應,而一些PD-L1陰性腫瘤患者對ICI免疫療法反應良好。
TMB高反應患者的異質性反應
突變負荷是新抗原負荷的一種合理近似替代物,已被用于在各種實體瘤類型中識別ICI免疫療法的有利應答者。然而,TMB高的患者對ICB治療的反應是高度異質性的,相當一部分TMB水平較低的患者也可以從ICI免疫療法中獲益,反之亦然。
對于對ICI治療反應不佳的TMB高風險患者,缺陷/失調的抗原呈遞機制被認為是免疫治療抵抗的主要機制,尤其是HLA的單倍型和區域表達,以及B2M分子的表達。此外,系統發育分析發現,克隆異質性,無論是通過構成腫瘤的克隆數量來衡量,還是通過克隆分化來衡量,都對ICI治療的生存結果產生了深遠的影響。
MMR缺陷患者的異質性反應
缺乏MMR的患者對ICI治療極為敏感,這在很大程度上歸因于升高的預測新抗原和改善的免疫原性腫瘤微環境。在眾多實體瘤類型的晚期dMMR患者中,pembrolizumab作為MSI-H腫瘤患者的最佳治療方法獲得了前所未有的認可。然而,只有少數患者對ICI治療反應良好。
dMMR腫瘤的腫瘤細胞內在基因型和外在免疫環境都可以影響其療效,在dMMR腫瘤中,浸潤免疫細胞基因組不穩定性的程度似乎在很大程度上是異質性的,導致免疫原性有限的離散生態位和免疫介導的腫瘤控制不足,這可能導致耐藥性。此外,影響MSI-H腫瘤對ICI反應的其他變量包括,在發育過程中,它們傾向于執行強大的免疫編輯和轉化為糖酵解譜,這在很大程度上有助于免疫逃逸。
針對公共抗原
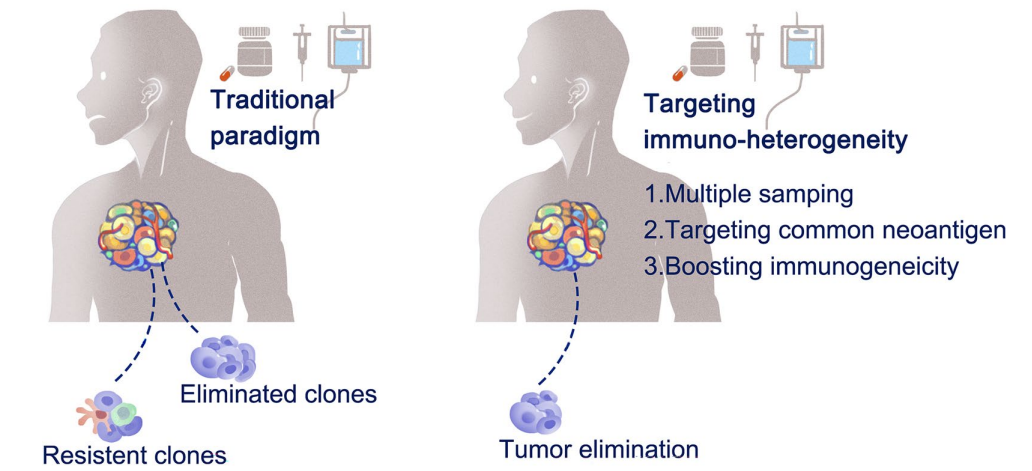
存在空間上不同的免疫原性是免疫治療產生異質性反應的根本原因。克服這一障礙的合理策略包括開發可針對整個腫瘤生態位的共享新抗原或均勻表達的腫瘤相關抗原(TAA)。
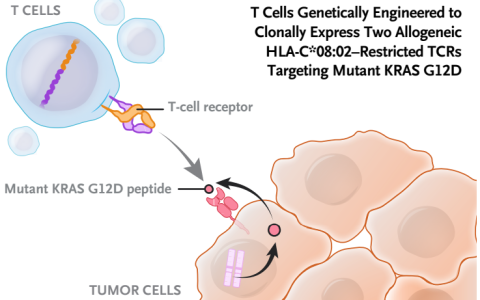
與個性化的新抗原相比,公共或共享的新抗原來源于癌基因的驅動突變或基因組中的其他熱點突變。它們的特征是具有特定癌癥亞型的患者子集中呈現的免疫原性表位。因此,公共新抗原的發現依賴于從相當大的患者庫中分析個體化新抗原。公共新抗原的一個例子是KRAS上G12D的突變,該突變在胰腺癌、結腸腺癌、非小細胞肺和結直腸癌中常見。類似地,TP53是一種眾所周知的腫瘤抑制基因,在大量癌癥中廣泛突變,具有廣泛的熱點突變,并為多種癌癥所共有。
多抗原靶向
通過同時靶向多個抗原來克服免疫原性異質性是另一個合理的途徑。這種策略最大限度地防止實體瘤中由于異質性免疫原性而導致抗原丟失時免疫逃逸的可能性。
目前,多種雙靶點策略已經應用于CAR-T細胞治療,兩種分別靶向不同表位的CAR-T細胞,或通過同時靶向多個表位的單個CAR-T細胞。例如,抗CD38/BCMA CAR-T細胞已在多發性骨髓瘤患者,抗CD19/CD22雙特異性CAR-T細胞在治療B-NHL患者中進行了測試。
促進免疫原性細胞死亡和表位擴散
在癌癥免疫治療中,腫瘤疫苗是一種很有前途的治療策略,不僅因為它能夠通過傳遞高度免疫原性抗原來引發炎癥環境,還因為它們通過促進表位擴散來拓寬和多樣化抗原譜。
隨著個人新抗原功能鑒定的突破,在長期臨床過程中,使用合成新抗原治療的患者不斷檢測到強大的新抗原特異性T細胞反應。隨著新抗原特異性T細胞克隆的持續存在,疫苗接種后還觀察到具有更廣泛規格的多樣化T細胞庫,從而提供了更大的可能性,以異種抗原性完全覆蓋腫瘤塊。除了直接提供合成肽外,編碼個性化新抗原的RNA疫苗或負載樹突狀細胞的新抗原疫苗也成功地動員了具有廣泛T細胞特異性的有效和持續的抗腫瘤免疫。
克服免疫微環境異質性的另一種策略是利用溶瘤病毒直接殺死惡性細胞,通過釋放大量免疫活性成分,包括隱匿的腫瘤相關抗原、危險信號、細胞因子和趨化因子,強烈促進免疫原性細胞死亡。這種伴隨的旁分泌作用對于激活腫瘤內空間周圍位點的非選擇性T細胞毒性至關重要,尤其是對于免疫原性相對較低的位點。除溶瘤病毒外,還可以引入各種方法,通過可溶性成分介導的機制激發炎癥免疫微環境,例如新型藥物、酪氨酸激酶抑制劑、陽離子兩性肽、微波、放射治療。所有這些都強調了一個關鍵問題,即強有力的治療反應通常涉及整個免疫微環境向免疫活性、同質環境的重塑。
腫瘤發生是一系列遺傳和非遺傳過程的綜合和累積失調。由于腫瘤基因組固有的遺傳不穩定性,在疾病進展過程中,大部分致瘤事件不可避免地以隨機方式發生。這些隨機事件在空間或時間維度上為異質性免疫微環境的發展創造了必要的條件。此外,對代謝物和營養素的競爭、治療壓力或關鍵癌基因的進化不斷重塑免疫微環境。這最終為惡性細胞逃避免疫監視創造了機會,最終導致疾病進展和轉移。
這種免疫異質性也是基于單個活檢的預測性生物標記物表現不佳以及對免疫療法產生耐藥性的原因。因此,考慮到腫瘤基因組的不穩定性和異質性的無休止發展,有必要關注從異質性腫瘤模型中吸取的經驗教訓。一個復雜的、受控的模型使我們能夠精確地理解對異質性的抗腫瘤免疫反應的調節機制。而治療方法不僅應考慮致癌靶點或代表性免疫檢查點,還應考慮免疫微環境的異質性和反應性。跟蹤腫瘤和免疫細胞之間的時空相互作用對于指導免疫療法的有效而持久的反應至關重要。
參考文獻:
1.Heterogeneity of the tumor immunemicroenvironment and its clinical relevance. Exp Hematol Oncol.?2022; 11:24.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/12680.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃