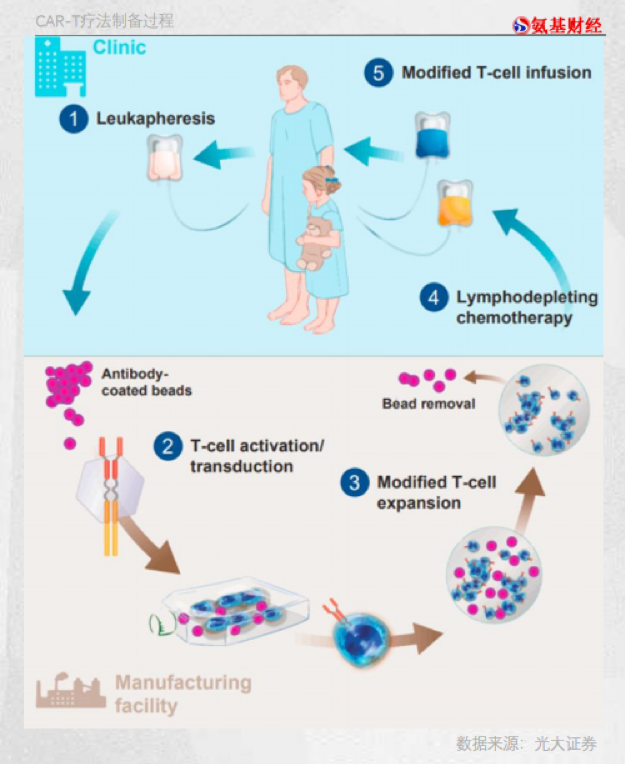
伴隨著傳奇生物CAR-T療法西達基奧侖賽的獲批,全球獲批的CAR-T療法數量也增至8個。 雖然CAR-T療法擁有超強的療效,但整個2021年全球市場規模卻僅為17億美元,遠遠低于PD-1、BTK、ADC等熱門賽道,僅能排在全球第九的位置。 制約CAR-T市場規模的原因主要有兩方面,一方面在于CAR-T療法上市較晚,患者依然需要時間去適應;另一方面則是最低37萬美元(國內120萬元)的天價治療費用,就算人均收入超過3.8萬美元的美國民眾,也很難負擔得起。 換句話說,目前天價治療費用的CAR-T注定只能被小部分富裕家庭接受,這嚴重限制了其市場天花板。降價乃是CAR-T療法未來發展的關鍵。 要降價,必須要降低成本。目前為止,獲批的CAR-T療法均屬于同種同體療法,需要從患者體內提取細胞,屬于高度定制化,難以批量化生產,效率過低嚴重抬高了CAR-T療法的成本。 此種背景下,能夠批量化的同種異體CAR-T或將成為破局關鍵。一旦首款同種異體CAR-T療法獲批,那么對于當前的CAR-T療法都將會是毀滅級沖擊。或許屆時才是CAR-T療法真正的發展“黃金期”。 / 01 / 規模化,CAR-T的天價痛點 縱觀全球已經獲批的CAR-T產品,高價似乎是大家最大的特點。與海外藥企對比,國內CAR-T產品的售價幾乎僅為海外市場的一半,但即使如此,價格依然成為CAR-T療法被詬病的地方。 市場將CAR-T療法視作天價,但藥企實則也很委屈,因為它們真得是“賣一個,賠一個”。 作為國內第二款上市的CAR-T產品,藥明巨諾的瑞基奧侖賽注射液(倍諾達)曾被寄予厚望,然而2021年財報卻顯示,2021年倍諾達的銷售額僅為3079.7萬元,毛利為900萬元,毛利率為29.4%。 這還沒有包括檢測、人力和冷鏈物流成本,再加上藥企高昂的研發費用,即使CAR-T療法定價129萬元,其中的利潤也是很薄的,甚至暫時陷于虧損。 如果CAR-T療法本身不進行變革,那么藥企實則并沒有太大的降價空間,“平價”也就成為患者最美好的幻想。 而CAR-T療法之所以如此昂貴,是因為目前其完全是“按需定制”,基于患者自體細胞進行改造。 醫生首先需要從患者外周血中提取T細胞,并在體外對這些細胞進行基因改造,給它們裝上識別癌細胞表面特定抗原的“嵌合抗原受體”(CAR),使之能夠靶向在腫瘤細胞表面表達的靶抗原。然后,再通過體外擴增、純化后,將其輸注回患者體內。整個生產周期在半個月以上,如Yescarta需要16-18天,諾華的Kymriah為22-29天。 不同患者的T細胞存在明顯差異,這就讓CAR-T療法的生產過程難以被標準化監控,GMP驗證十分困難,很難形成規模效應。 尤其最關鍵的是遞送載體環節,如果無法形成規模,那么生產成本很難進一步下降。 慢病毒是當下最主流遞送載體,直接參與CAR轉染T細胞的關鍵過程。目前,全球僅有葛蘭素史克、Oxford、BioMedica等幾家企業具有病毒載體制備的核心技術及規模化生產工藝,并且得到監管機構的認證。 在理想的狀態下,病毒載體的成本占比應該僅在4-5%,然而如若病毒載體產量不佳時,對成本影響極大。以葛蘭素史克的慢病毒載體生產為例,生產100劑CAR-T慢病毒載體時,成本到達2.5萬美元/劑,當產量提升至1000劑時,成本約下降至4000美元/劑;進一步提升產量至10000劑時,成本將驟降至1500美元/劑。 產能利用率和病毒載體是目前對CAR-T療法生產成本影響最大的兩項因素,而這都可以通過規模化來實現。由此來看,CAR-T療法的癥結正在于規模化上。 / 02?/ 破局關鍵:“異體”CAR-T的崛起 2018年8月,一位名叫蕾拉剛滿“百天”的英國女嬰被診斷為急性淋巴細胞白血病,對嬰兒來說這種疾病相當難治療。 很快,醫生就開始對蕾拉進行了化療和骨髓移植,但可惜的是,僅僅7周后這些傳統治療手段就被宣告無效。當醫生也束手無策時,一種新型的“基因編輯”細胞療法成為突破口。 在女孩父母的支持下,醫院開始采用由德國生物技術公司Cellectis所開創的全新細胞療法,其核心是將抗癌基因插入健康的捐贈者T細胞中,從而生成CAR-T細胞,并注入患者身體中。正是這5000萬個被基因編輯過的細胞收到了奇效,癌細胞被全面抑制,很快醫生就再次進行了骨髓移植以確保根除疾病。 蕾拉正是全球第一位由“異體”CAR-T療法治愈的癌癥患者,治愈她的是Cellectis公司的UCART19產品。由于注入她體內的細胞來自健康的捐贈者,這也讓市場看到了同種異體CAR-T療法全面推廣的可能性。 “異體”CAR-T療法相當于一種“通用型”的CAR-T技術。捐獻蕾拉細胞的是一位素未相識的美國志愿者,科學家經過三次基因修改后,讓其成功化身為通用型CAR-T細胞。 在今年5月19日舉辦的美國基因與細胞治療學會年會上,美國生物公司Allogene對外披露:來自健康、年輕供體的細胞比來自癌癥患者的細胞更豐富,具有更大的健康和癌癥殺傷潛力。 Allogene的研究意味著,同種異體CAR-T療法具備改善患者預后的潛力,甚至能夠讓很多因自身細胞質量不適合進行CAR-T療法的癌癥患者,也能使用CAR-T療法,幫助CAR-T療法的應用場景進一步擴大。 如果這項技術得到充分的發展,對患者進行充分的研究,那么理論上就可以省掉從患者身體提取T細胞的過程,不僅能讓整個CAR-T細胞培育過程大幅縮短,而且可以讓患者的范圍進一步擴大,有助于提升藥企的產能利用率。 甚至藥企可以根據患者的訂單情況,有計劃地提前進行CAR-T細胞制備,讓慢病毒載體得到規模化量產,從而降低整個CAR-T療法的成本。 由此分析,通用型CAR-T療法是規模化的關鍵,甚至可能是CAR-T療法成本下降的必經之路。 / 03?/ 副作用之痛 不同于全球已經有8款同種同源CAR-T產品獲批上市,目前所有的通用型CAR-T療法都處于臨床早期階段,距離產品正式獲批上市依然有一段距離。 目前,Cellectis、Allogene、Caribou、CRISPR、Precision等公司是國際同種異體CAR-T技術的先驅者。其中,Cellectis公司是最早進行“異體”CAR-T療法研究的公司,而Allogene則是目前競爭力最強的公司。 Allogene公司由Kite醫藥前CEO和CMO聯合創立,他們正是Kite公司CAR-T療法獲批的關鍵人物。除明星創始人,Allogene還從輝瑞收購了一系列實驗性細胞療法,并獲得了Cellectis旗下基因編輯技術TALEN?和UCART19管線的獨家許可使用權。 目前,Allogene公司對外宣稱擁有16條產品管線,其中ALLO-715和ALLO-605分別獲得FDA的孤兒藥資質,可以獲得快速審批、減免稅費、免除申報費用、研發補助和七年的市場獨占權。從這也能看出,FDA對于通用型CAR-T療法寄予厚望。 不久之前,另一家美國公司Caribou宣布,旗下通用型CAR-T療法CB-010,在治療復發/難治性B細胞非霍奇金淋巴瘤患者的1期臨床試驗中獲得積極結果。在接受初始劑量的5名患者中,獲得100%總緩解率和80%的完全緩解率。CB-010成為首款獲得100%總緩解率的同種異體CAR-T療法。 盡管市場對于通用型CAR-T療法充滿期待,但副作用依然是藥企必須攻克的課題,畢竟藥品最重要的就是安全。 無論是Cellectis還是Allogene,它們的管線都曾因安全問題而被FDA暫停臨床試驗。 2017年2月,Cellectis公司的管線UCART123獲得FDA的IND批準,成為首款獲批的通用CAR-T管線。但在當年8月,UCART123的一位患者就死于細胞因子釋放綜合征(CRS),出于安全的考慮,FDA曾短期暫停了UCART123的試驗開展。 2020年7月,在Cellectis公司針對發性骨髓瘤(MM)管線UCARTCS1A的臨床試驗中,又一名患者因心臟驟停而亡,而后FDA又緊急暫停該試驗。一年之后,Allogene公司的管線ALLO-501A又出現患者“染色體異常” 的情況,FDA再次叫停了試驗。 此般種種表明,副作用是目前通用型CAR-T療法遇到的最嚴峻的問題。畢竟自體CAR-T都有可能出現副作用問題,更不要說來自其他人的細胞了。 在此之前,副作用也一度是抑制自體CAR-T療法發展的問題之一。由于T細胞在短期內大量被活化,細胞因子的釋放短時間內呈爆發式增長,導致細胞因子釋放綜合征(CRS)、巨噬細胞活化綜合征等嚴重不良反應。此外,CAR-T療法還有可能產生神經毒副作用,臨床上常用托珠單抗活糖皮質激素來治療。 如何克服副作用阻礙,成為決定通用型CAR-T療法能達到怎樣高度的關鍵。 除上述副作用,通用型CAR-T療法還存在兩大問題:輸入患者的異體細胞可能對宿主進行攻擊,導致危及患者生命的移植物抗宿主病;由于人體的自身免疫限制,異體細胞可能迅速被宿主的免疫細胞識別并消滅,限制它們的抗腫瘤活性。 不過,此前每一次FDA暫停通用型CAR-T的臨床試驗,都會在排除問題后很快恢復試驗,這也表明FDA同樣期待通用CAR-T療法的表現。 / 04?/ 布局未來,國內入局者近10家 縱觀全球,通用型CAR-T療法都算得上是一項十分前沿的技術,在這項技術上,國內企業實則也已開始布局。 今年3月17日,北恒生物自主研發的CTA101 正式獲得NMPA的臨床試驗默示許可,使其成為中國第二款進入臨床階段的通用型CAR-T療法。 在此之前,亙喜生物開發的GC007g注射液于2020年12月獲得NMPA的臨床試驗默示許可,成為國內第一款進入臨床階段的通用型CAR-T療法。目前亙喜生物正在推進2期試驗前第二個劑量隊列的患者入組。 除此之外,傳奇生物、邦耀生物、博生吉、科濟生物、茂行生物、克睿基因、森朗生物也都在進行通用型CAR-T療法的相關布局。 總的來看,通用型CAR-T療法具備大幅降低CAR-T療法成本的潛力,但前提是藥企必須解決副作用的問題。 雖然歐美藥企領跑通用型CAR-T療法的研發進度,但中國藥企落后的并不算遠。一場關于通用型CAR-T療法的未來爭奪戰,已經拉開了序幕。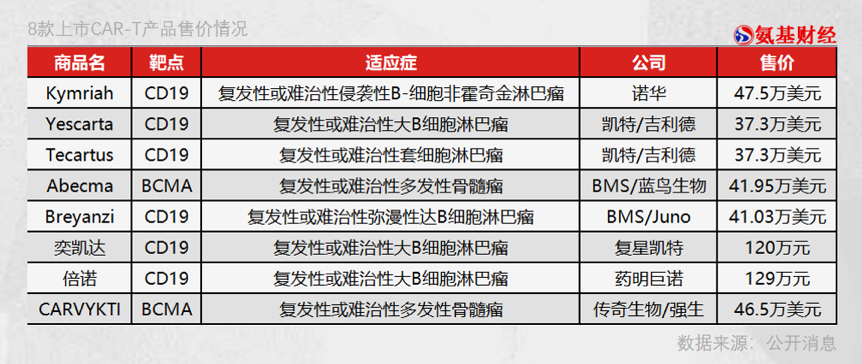

編輯:小果果,轉載請注明出處:http://www.448371.com/zixun/hydt/15481.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃