作者:觀Sir
排版:時光深巷
01
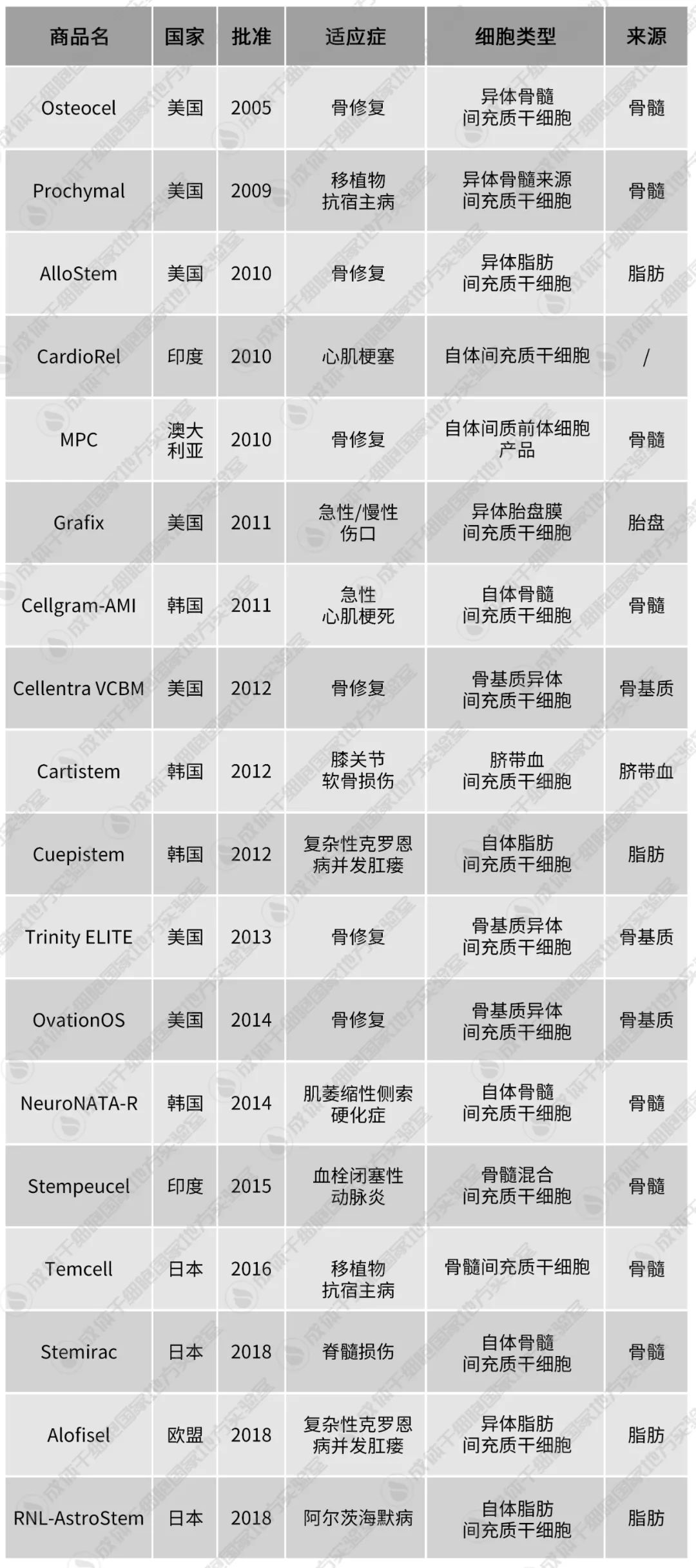
多點開花,Mesoblast

Prochymal:移植物抗宿主病
|
國家 |
美國、加拿大、新西蘭 |
|
日期 |
2010-05? |

|
細胞類型 |
骨髓間充質干細胞 |
|
適應癥 |
移植物抗宿主病、克羅恩病 |
|
價格 |
20萬美元/療程 |
最初,美國FDA以孤兒藥的方式批準其用于I型糖尿病的治療。
2012年,Prochymal被賣給澳大利亞的Mesoblast,并在加拿大、新西蘭獲批上市,治療急性移植物抗宿主病。
2015年,Mesoblast與JCR合作,將其改名Temcell在日本上市。
Temcell:移植物抗宿主病
|
國家 |
日本 |
|
日期 |
2016-02 |

|
細胞類型 |
骨髓間充質干細胞 |
|
適應癥 |
移植物抗宿主病 |
|
價格 |
約12萬美元/系列療程 |
如前所述,Temcell前身是Osiris公司的Prochymal,Mesoblast公司的Ryoncil。
2019年,TEMCELL又被批準治療大皰性表皮松懈癥和新生兒缺氧缺血性腦病。
在JCR的財報中,Temcell的銷售收入在2018年約1800萬美元,2019年約2800萬美元。
MPC:骨修復
|
國家 |
澳大利亞 |
|
日期 |
2010-07? |
|
細胞類型 |
自體間質前體細胞 |
|
適應癥 |
骨修復 |
|
價格 |
未知 |
2010年,Mesoblast自主研發的MPC(Mesenchymal Precursor Cell)在澳大利亞獲得批準上市,用于受損組織的修復和再生。

Mesoblast目前市值約10億美元,2020財年660萬美元商業收入全部來自Temcell,主要收入來自中國、日本等合作方的里程碑付款(2500萬美元)。
02
先行先試,韓國FDA

CellGram:急性心肌梗死
|
國家 |
韓國 |
|
日期 |
2011-07? |

|
細胞類型 |
自體骨髓間充質干細胞 |
|
適應癥 |
急性心肌梗死 |
|
價格 |
1.5萬美元 |
CellGram在胸絞痛發生后72小時內,通過冠狀動脈成形術使用,以改善心肌梗死患者的左心室血細胞計數。在治療6個月后測量顯示,每一次治療提高了6%的左心室射血分數。
到2017年,這種療法已經創造了約780萬美元的銷售額。但CellGram在6年期限內未能滿足治療600名患者的條件,Pharmicell公司申請將患者最低數量要求降低到60人,遭到拒絕。
一些行業觀察家因此猜測韓國會取消其批準,但這是韓國第一個干細胞藥,“批準的取消將對國家聲譽產生有害影響,我們必須做出謹慎的決定。”
Cartistem:退行性關節炎
|
國家 |
韓國 |
|
日期 |
2012-01 |
|
細胞類型 |
臍血間充質干細胞 |
|
適應癥 |
退行性關節炎和膝關節軟骨損傷 |
|
價格 |
1.9-2.1萬美元 |
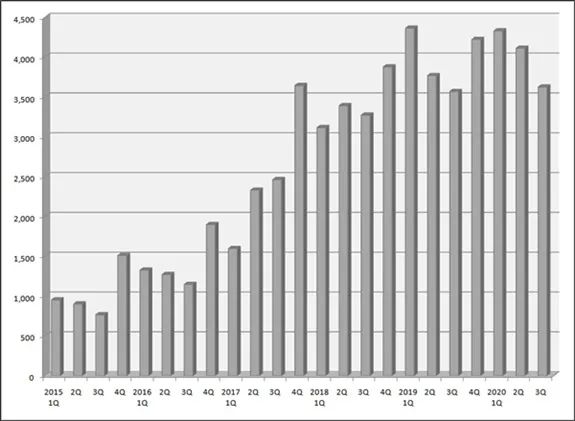
在Cartistem上市應用的8年中,累計銷售已經超過18000劑。
從2017年到2020年,Cartistem已連續4年銷售額超過100億韓元(約900萬美元),這一表現明顯優于韓國批準的另外3款干細胞藥品(年銷售額都不到50億韓元)。
Kim SJ等研究者對128名產品使用者進行了回顧性分析,結果發現在隨訪2年后,這些患者的疼痛和功能得到改善,且有統計學意義。
目前,該產品已在美國完成I期和IIa期臨床試驗,正在日本開展II期臨床試驗。
Cupistem:克羅恩病
|
國家 |
韓國 |
|
日期 |
2012-01 |

|
細胞類型 |
自體脂肪間充質干細胞 |
|
適應癥 |
復雜性克羅恩病并發肛瘺 |
|
價格 |
3000-5000美元 |
Cupistem被用于減輕克羅恩氏瘺管的炎癥。
在一項II期臨床試驗中,43個患者在12個月后評估了瘺管愈合情況,其中80.8%的患者表現為完全的瘺管愈合。24個月后,這些患者中有75%完全閉合,顯示出可持續的安全性和治療效果。
NeuroNATA-R:肌萎縮側索硬化癥
|
國家 |
韓國 |
|
日期 |
2014-07 |
|
細胞類型 |
自體骨髓間充質干細胞 |
|
適應癥 |
肌萎縮側索硬化癥、運動神經元病 |
|
價格 |
1.8-7.2萬美元(根據體重) |
NeuroNATA-R是韓國Corestem公司提供的干細胞療法。在每次注射干細胞的4周前,需要從患者自身的骨髓中采集間充質干細胞。
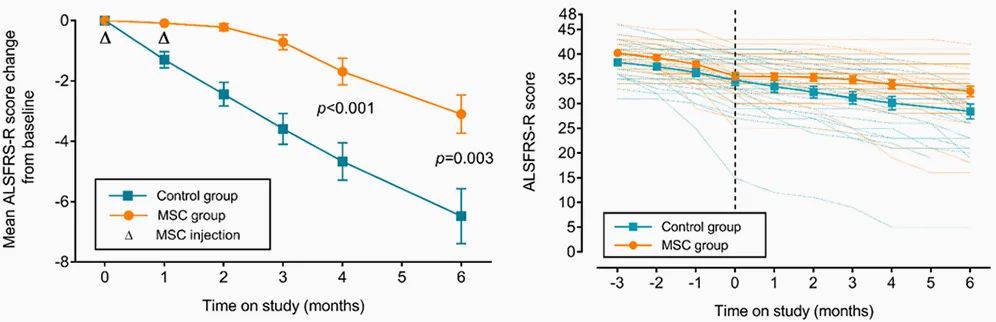
在評估安全性的I期臨床試驗中,有7位患者接受了鞘內注射兩次,并隨訪了12個月。該研究顯示它有良好的安全性。
03
不甘落后,日本印度
Stempeucel:嚴重肢體缺血
|
國家 |
印度 歐盟批準 |
|
日期 |
2015-06 |
|
細胞類型 |
骨髓間充質干細胞 |
|
適應癥 |
血栓閉塞性動脈炎 |
|
價格 |
2200美元(2017) |
2015年,Stempeucel以孤兒藥的形式獲得了歐洲藥品管理局(EMA)的批準,治療血栓閉塞性動脈炎。
2017年,印度藥品管理總局(DCGI)授予了Stempeucel有限營銷許可,用于治療因Buerger病引起的嚴重肢體缺血患者。2020年,DCGI完成了正式批準。
Stempeucel的研發歷時12年,最終成為印度第一個被批準用于商業用途的同種異體細胞治療產品。
Alofisel:克羅恩病
|
國家 |
日本 歐盟批準 |
|
日期 |
2018-3 |

|
細胞類型 |
脂肪間充質干細胞 |
|
適應癥 |
克羅恩病患者復雜肛周瘺 |
|
價格 |
約7萬美元/療程 |
2018年,日本制藥巨頭Takeda與比利時干細胞公司TiGenix聯合宣布,EMA已批準Alofisel (darvadstrocel,Cx601),用于瘺管對至少一種傳統或生物療法反應不足的克羅恩病復雜性肛周瘺的治療。
但Alofisel在獲得所謂第三級批準時遇到了一些困難,這是用來指代國家級付款人保險的術語。例如,英國NICE拒絕推薦Alofisel,理由是其在臨床試驗中獲益不大。
2019年,Takeda決定在歐洲采取基于價值的定價。也就是說,如果患者沒有改善,他們將承擔部分或全部費用。
在截止2020年3月31日的財政年度中,Takeda從Alofisel獲得的收入約35萬美元。
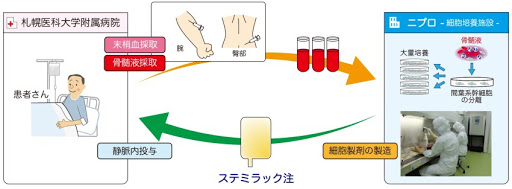
Stemirac:脊髓損傷
|
國家 |
日本 |
|
日期 |
2018-12 |
|
細胞類型 |
自體骨髓間充質干細胞 |
|
適應癥 |
脊髓損傷 |
|
價格 |
13.5萬美元 |
Stemirac的上市有些爭議,它只做了II期臨床試驗,就獲得了有條件批準,并被納入國民健康保險。
此舉遭到Nature批評,認為其臨床試驗中沒有對照組,治療組只有13名受試者。而日本方面則回應,設立對照組可能產生道德問題。
據2019年的一篇文章預測,Stemirac將在未來9年中,每年給Nipro公司帶來約340萬美元的收入。
04
上市不是終點,效價比很關鍵

編輯:小果果,轉載請注明出處:http://www.448371.com/zixun/hydt/11002.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。




 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃