????3月3日科濟藥業發布公告“自愿公告 – CT041獲得同意在中國進入確證性II期臨床試驗用于治療晚期胃癌╱ 食管胃結合部腺癌”

根據以往資料整理如下:

一、試驗目的:
??? Ib期劑量探索階段的主要目的:評價兩組受試者首次輸注CT041后4周內的安全性和耐受性確定RP2D;?
??? Ib期劑量擴展階段和II期有效性安全性確認階段的主要目的:評價總隊列1受試者輸注CT041后24周內的有效性;評價總隊列2受試者輸注CT041后12周內的有效性。
????適應癥:至少二線治療失敗的晚期胃/食管胃結合部腺癌和至少一線治療失敗的晚期胰腺癌
二、申請人:上海科濟制藥有限公司
? ? ? 倫理委員會:北京腫瘤醫院醫學倫理會
三、入組標準
??? 1. 自愿參加臨床試驗;本人完全了解、知情本研究并簽署知情同意書;愿意遵循并能完成所有試驗程序
????2. 年齡在18~75歲,男女均可
??? 3. 經病理確診的晚期胃/食管胃結合部腺癌患者,且接受至少二線治療失敗;或經病理確診的晚期胰腺癌患者,且至少一線治療失敗
????4. 受試者腫瘤組織樣本免疫組織化學(IHC)染色為CLDN18.2呈陽性
????5. 預計生存期 >12周
????6. 按照RECIST1.1標準要求存在可測量腫瘤病灶
????7. 篩選期、單采前24小時內 ECOG體力狀態評分0~1
????8. 具備單個核細胞采集(簡稱單采)足夠的靜脈通路
????9. 受試者在篩選和預處理前(基線時)應滿足一定器官功能條件
??? 10. 育齡期女性受試者必須在篩選時和接受預處理前進行血清妊娠試驗且結果為陰性,并愿意在使用末次研究治療后1年內采用非常有效可靠的方法避孕。
??? 11. 與有生育潛能的女性有活躍性生活的男性,如果沒有做輸精管結扎術,必須同意使用阻隔法節育。
三排除標準
????1. 妊娠或哺乳期女性
????2. HIV、梅毒螺旋體或HCV血清學反應陽性
????3. 任何不可控的活動性感染
????4. 既往治療造成的毒副反應未恢復至CTCAE ≤1級
????5. 已知患有活動性自身免疫性疾病,或其他需要長期使用免疫抑制療法疾病的受試者
????6. 既往對免疫治療過敏,對相關藥物過敏,既往嚴重過敏史,對CT041成分過敏
????7. 既往接受過任何基因工程修飾T細胞治療
????8. 存在腦轉移或有腦轉移癥狀
????9. 引起出血或穿孔的高風險受試者
????10. 需要進行抗凝治療的受試者
????11. 需要長期抗血小板治療的受試者
????12. 有器官移植病史或正等待器官移植的受試者
????13. 單采前4周內進行過重大外科手術或發生顯著創傷,或預期需要在研究期間進行重大手術的受試者
????14. 單采前存在其他嚴重的可能限制受試者參加此試驗的疾病
????15. 研究者評估認為受試者不能或不愿意依從研究方案要求
????16. 受試者出現經研究者判斷不適合繼續進行試驗的情況
????17. 受試者有中樞神經系統疾病征兆或具臨床意義的神經系統檢查結果異常
????18. 既往3年內或同時患有其他未治愈的惡性腫瘤,原位宮頸癌、皮膚基底細胞癌除外
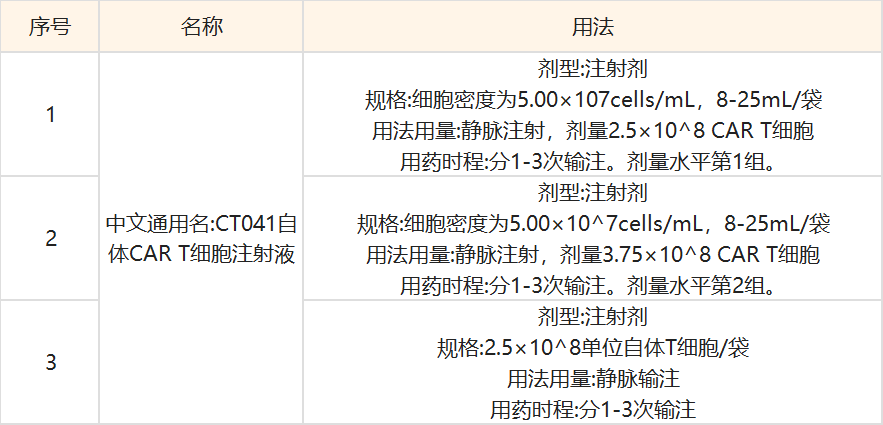
五、試藥分組
六、主要研究者信息
????1.北京腫瘤醫院??沈琳
??? Email:doctorshenlin@sina.cn

????主任醫師、教授、博士生導師。現任北京大學腫瘤醫院副院長、消化腫瘤內科主任、I期臨床病區主任、北京市腫瘤防治研究所副所長。專業方向為消化系統腫瘤的診斷與治療,特別是胃腸道腫瘤的綜合治療與個體化治療,是我國胃腸道腫瘤多學科綜合治療(MDT)的發起人、倡導者和推廣者。
????2.復旦大學附屬腫瘤醫院??虞先濬

????復旦大學附屬腫瘤醫院副院長,上海市/復旦大學胰腺腫瘤研究所所長
? ? Email:yuxianjun@fudanpci.org
主要從事胰腺癌的臨床和基礎研究,特別致力于胰腺癌分階段綜合治療研究,甲基化調控對胰腺癌高度惡性表型,高轉移復發性的研究和胰腺癌淋巴轉移特性與靶向治療的相關研究
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lczm/10588.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃 





