介紹
傳統過程通常需要 2-6 周。新方法可以將自體 CAR-T 細胞的制造時間從行業標準時間縮短。FasT CAR平臺能夠使用源自慢病毒的XLenti載體同時激活靜息T細胞并將其轉導為單個“同時激活-轉導”步驟。ASH年會的摘要顯示,在CAR-T細胞制造過程中,每個階段都有不同的功能和代謝要求,微小的變化會對CAR-T細胞治療的療效和副作用產生很大的影響[7](圖 1)

圖 1 T細胞根據其功能有不同的代謝需求。
T細胞代謝的重新編程
T細胞亞群分為幼稚T細胞(Tn)、效應T細胞(Teff)、中樞記憶 (Tcm)、效應記憶(Tem)等,每種都有不同的功能和代謝要求。T細胞活化和代謝重編程同時發生。
Tn的代謝主要依靠氧化磷酸化(OXPHOS)和脂肪酸氧化(FAO)來提供能量。遇到抗原后,TCR和CD28協同激活PI3K-AKT-mTOR通路。T細胞活化信號通路(例如PI3K-AKT-mTOR 通路)激活轉錄因子(例如HIF-1α、c-Myc),從而上調1型葡萄糖轉運蛋白(GLUT1)的表達以促進糖酵解。然而,無論是通過交聯TCR/CD3復合物激活還是單獨連接CD28,都不會引起Glut1表達的顯著變化。總之,這使細胞能夠滿足快速增殖和細胞因子產生的代謝需求。這導致Tn細胞分化為Teff細胞。記憶T細胞的代謝模式與Tn相似,但具有稍高程度的OXPHOS和線粒體備用呼吸能力,這使得記憶T細胞在遇到抗原時迅速激活。一旦抗原被清除,大多數Teff會發生凋亡,少數會分化為記憶 T細胞。這時,代謝必須從糖酵解轉化為FAO。代謝是決定記憶T細胞命運的主要驅動因素。活化的T細胞通過調節代謝來控制代謝中間體的數量和類型,這些中間體用于控制關鍵基因轉錄的表觀遺傳反應,促進T細胞分化為記憶T細胞。然而,這一過程所涉及的具體機制仍然知之甚少。
目前大多數可用的 CAR-T 療法都是使用慢病毒制造的。在制造CAR-T細胞時,我們首先通過白細胞分離術或Ficoll獲得PBMC。PBMC被純化獲得T細胞,然后用抗分化簇3(CD3)/CD28磁珠刺激T細胞以促進增殖和分化。此時,新陳代謝被重新編程(從FAO到糖酵解)。在激活過程中,需要更多葡萄糖的細胞傾向于分化為Teff,而那些需要較少葡萄糖的細胞優先形成記憶T細胞。
接下來,T細胞被轉導,最常見的是通過慢病毒感染。也就是說,將獲得的T細胞亞群與編碼CAR的慢病毒載體一起孵育。研究表明,T細胞亞群的組成及其代謝適應性與其抗腫瘤活性密切相關。由純化的CD4+或CD8+ Tcm或Tn制成的CD19 CAR-T細胞已被證明具有增強的代謝適應性和長期抗腫瘤反應。與標準制造的CD19 CART 相比,源自TSCM的CD19 CART顯示出良好的長期反應,但尚不清楚是否只是具有更多的Tscm或Tscm的糖酵解減少會驅動長期反應。研究表明,這可能與早期記憶表型和FAO依賴性OXPHOS有關。
最后,CAR-T細胞在體外擴增到一定數量。在重新懸浮和純化后,細胞通過輸注返回給患者。臨床研究表明,具有較高比例的記憶T細胞和糖酵解的19種CAR-T細胞增加了慢性淋巴細胞白血病細胞(CLL)患者CR的機會。制造CAR-T過程中的其他條件,例如感染溫度,也會影響CAR-T的分化。是否影響新陳代謝需要通過慢病毒技術進一步研究。
優化代謝提高生產效率

圖2 ?T細胞和CAR-T細胞體外擴增需要適當的代謝(直接或間接抑制糖酵解)維持未分化狀態,可延長體內持續時間,增強抗腫瘤活性;然而,在體內,有必要增強代謝(糖酵解或OXPHOS)活性以維持高侵襲潛力和殺傷功能。
在T細胞擴增期間抑制糖酵解以限制分化
如上所述,純化的T細胞一旦獲得,必須在體外擴增3天,然后才能用于制造CAR-T細胞。在此過程中,除了CD3/CD28磁珠外,還會定期添加細胞因子。白細胞介素2 (IL-2) 是最常添加的細胞因子,因為它促進T細胞的糖酵解和快速增殖。IL-2還介導T細胞擴增和效應分化的生理耦合;然而,細胞擴增和效應分化的耦合對提高免疫治療的療效構成了主要的治療障礙。多項研究表明,T細胞代謝是擴增和分化的關鍵調節因子。T細胞增殖和分化可以通過代謝途徑的操縱來解耦。在制CAR-T細胞之前,可以通過直接抑制糖酵解(糖酵解抑制劑抑制PI3K/AKT 信號通路)或間接(促進線粒體功能、優化培養基)將T細胞維持在未分化狀態。
CAR-T細胞制備階段:選擇抑制糖酵解的CAR結構維持低分化
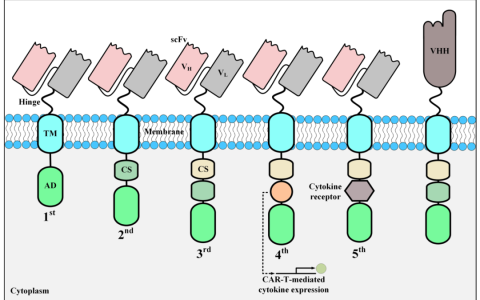
CAR的結構包含可變區抗體的單鏈片段、跨膜結構域、共刺激分子和細胞內信號結構域。CAR-T細胞技術現在已經發展了五代。目前市場上的產品都是第二代CAR-T細胞。在CAR-T細胞制備階段,可以利用抑制糖酵解的CAR結構來維持幼稚,提高CAR-T細胞治療的療效。例如,選擇有利于OXPHOS的共刺激因子和抑制糖酵解的PI3K抑制區域的共表達。
體外擴增CAR-T細胞:抑制糖酵解并維持未分化狀態
與T細胞相比,CAR-T細胞中的CAR-CD3ζ ITAM信號可以促進分化,使CAR-T細胞更容易分化為Teff和Tem細胞,結果是CAR-T細胞在體內的持久性較差。因此,通過調節CAR-T細胞擴增過程中的代謝途徑來解耦CAR-T細胞的增殖和分化就顯得尤為重要。
優化培養基
通常,CAR-T細胞是使用富含碳水化合物和氨基酸等營養物質的培養基在體外產生和擴增的。然而,腫瘤微環境(TME)中缺乏氧氣和營養物質限制了CAR-T細胞的擴增和功能。因此,在擴增過程中,優化培養基成分,適當抑制CAR-T細胞的糖酵解,有助于提高代謝適應性,維持低分化狀態。例如,添加精氨酸可以促進OXPHOS并抑制糖酵解。添加肌肽可以中和有氧糖酵解產生的細胞外質子,并且可以將CAR-T細胞代謝從糖酵解轉變為OXPHOS。
特別是,添加到CAR-T細胞培養物中的最常見的細胞因子IL-2可促進糖酵解以促進T 細胞快速增殖。然而,它也可能驅動終末分化或活化誘導的細胞死亡。調整IL-2添加到培養基中的濃度和時間可以減少CAR-T細胞的副作用并提高療效(增加記憶CAR-T細胞亞群的比例)。其他類型的細胞因子,如IL-15,通過降低mTORC1活性和抑制其糖酵解活性來改善代謝適應并保持CAR-T細胞的干細胞記憶表型。IL-21將代謝轉向FAO和OXPHOS,以促進Tcm細胞的形成。IL-7和IL-15不僅可以誘導 Tscm 的形成,還可以逆轉CAR-T細胞耗竭。綜上所述,這些數據表明,適當優化代謝可以產生具有很強代謝適應性的CAR-T細胞。為了使CAR-T細胞在輸注前達到最佳狀態,需要進一步研究最佳培養基成分(包括細胞因子、營養物質等)的比例。
簡而言之,CAR-T細胞可以直接通過抑制糖酵解或間接通過增強線粒體代謝來維持低分化狀態。這種代謝的可調節性為促進CAR-T細胞功能提供了機會。
注入患者體內后促進CAR-T細胞功能的策略
將CAR-T細胞注入患者體內時,必須考慮體內代謝需求,而體外則相反。具有高代謝活性的T細胞可以更好地殺死腫瘤細胞。然而,CAR-T細胞的代謝受到缺氧和營養缺乏的影響。CLL會降低T細胞的葡萄糖攝取并損害線粒體的生物合成。最近的研究表明,增強體內糖酵解或線粒體代謝可以改善CAR-T細胞的功能。此外,由于腫瘤細胞與CAR-T細胞之間的競爭性代謝,還可以通過抑制腫瘤細胞的代謝來促進CAR-T細胞在體內的功能。
增強葡萄糖代謝
此外,TME中的抑制性細胞因子和分子可激活磷酸酶并抵消AKT信號。在ALL小鼠模型中,GLUT1或AKT的表達增加了T細胞效應功能。為了克服TME中AKT表達的下調,使CAR-T細胞過表達 Akt 可提高抗腫瘤功效。與caAkt-GD2-CAR 共轉導的T細胞產生更多的Th1細胞因子和顆粒酶B,從而增加了對LAN-1神經母細胞瘤細胞的細胞毒活性。然而,持續的Akt激活會驅動CD8+ T細胞記憶的終末分化和喪失。上文提出,在體外CAR-T細胞培養過程中抑制PI3K/AKT信號通路,可通過抑制糖酵解延緩CAR-T細胞分化,使表型趨于持續更長時間的記憶T細胞。然而,過表達AKT的CAR-T細胞增強了T細胞的效應功能。這兩項研究從不同的角度操縱了CAR-T細胞以增強抗腫瘤功效,并值得進一步研究以確定哪種方法更優越。
在TME中,腫瘤細胞迅速消耗細胞外葡萄糖,抑制T細胞糖酵解和下游代謝物磷酸烯醇丙酮酸(PEP)的產生。除了在糖酵解中的作用外,PEP還調節T細胞中的細胞質Ca2+濃度和NFAT1活化,并且是調節抗腫瘤反應的關鍵代謝物。過表達PCK1的T細胞會增加PEP的產生,限制腫瘤生長,并延長黑色素瘤小鼠的存活時間。此外,Von Hippel Lindau基因或脯氨酰羥化酶的突變或敲除可以增強糖酵解,促進抗腫瘤活性,并延長T細胞的持久性。這種觀點似乎與抑制糖酵解延長T細胞的持久性相矛盾,這再次證明了T細胞代謝的復雜性。
增強線粒體代謝
在2020年ASH年會上提交的一份初步報告表明,增強腫瘤部位免疫細胞的線粒體代謝可以促進腫瘤殺傷。FOXM1基因的過表達誘導CAR-i Tscm,并通過促進線粒體生物合成、脂肪酸合成和OXPHOS增強抗腫瘤作用。
抑制腫瘤細胞代謝
PD-L1在激活Akt-mTOR以促進糖酵解、增加葡萄糖攝取和增強與T細胞的葡萄糖競爭的癌細胞上表達。多項研究表明,通過單克隆抗體或工程化CAR結構阻斷PD-L1/PD1軸可提高CAR-T細胞的功效。原因之一是阻斷PD-L1/PD1軸直接抑制腫瘤細胞的糖酵解,恢復TME中的葡萄糖,從而促進CAR-T細胞的糖酵解和IFN-γ的產生。另一個原因是它可能直接促進 CAR-T細胞代謝和逆轉 CAR-T失敗。
除了抑制 PD-L1/PD1 軸外,糖酵解抑制劑也可用于直接抑制腫瘤細胞代謝,但腫瘤細胞與免疫細胞之間的代謝相似性可能導致直接抑制腫瘤細胞代謝,從而影響療效的免疫療法。選擇 GLUT1 抑制劑或生酮飲食可能是在不損害 CAR-T 細胞功能的情況下抑制腫瘤細胞葡萄糖代謝的潛在方法。
一些復雜的技術,如CRISPR可用于在臨床環境中對患者的T細胞代謝進行基因改造。CRISPR/Cas9可以敲除甘油二酯激酶,增加TCR信號,促進CAR-T細胞的殺傷功能。DGK KO增強了TCR遠端信號(ERK 磷酸化被放大并持續更長時間),從而增加了139個CAR-T 細胞的效應功能。瀏覽CRISPR/Cas9文庫和篩選結果顯示REGNASE-1可以促進代謝衰竭,并且Regnase-1-null CAR-T 細胞顯示出比野生型細胞更強的治療效果。
結論
這些細胞具有高侵襲潛力,但壽命短,不利于分化為基于OXPHOS代謝的記憶T細胞。另一方面,向OXPHOS的轉變促進了向記憶T細胞的分化,但增殖可能受到限制,遷移能力和殺傷功能可能會降低。在殺傷腫瘤的過程中,我們需要壽命長、侵襲能力強、殺傷功能高的CAR-T細胞。這促使我們計劃如何在制造過程中更好地調節CAR-T細胞的代謝。在體外擴增T細胞或 CAR-T 細胞期間適當抑制糖酵解(直接或間接)有助于記憶T細胞的形成,后者與CAR-T細胞在體內的持久性和治療功效直接相關。然而,需要增強CAR-T細胞在體內的代謝才能更好地發揮殺傷功能。
最近的研究將AMPK的γ亞基克隆到慢病毒載體中,以增加CAR-T細胞中的AMPK信號傳導,在體外促進擴增,同時促進記憶T細胞的分化。聚糖基化IL-10(AM0010)可以在體外和體內增強 CAR-T細胞的細胞毒性。通過對人IL-2的一個亞基(ortho-hIL-2)進行基因改造,與重組IL-2相比,除了在體外促進T細胞增殖外,還可以在體內促進T細胞增殖。通過基因改造對ortho-hIL-2進行輕微調整,不僅可以促進體外T細胞增殖,還可以促進體內T細胞增殖。
隨著CRISPR等學科的發展,未來可能在體內更精細地調控CAR-T細胞代謝。
efficacy during CAR-T cell manufacturing
https://doi.org/10.1186/s12967-021-03165-x
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/8526.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃