?
抗藥物抗體(ADA)是蛋白藥物成功臨床應用的一個主要障礙,降低患者的治療效果和安全性。預測抗體藥物的免疫原性,對于臨床試驗順利進展以及藥物臨床使用極其關鍵。
影響蛋白類藥物免疫原性的因素,包括治療性蛋白的內在和外在特性,患者相關因素(HLA單倍型、免疫狀態)、治療環境、藥物遞送方式和作用模式(MoA)等。
?
生物信息學評估
?
生物信息學主要用于預測藥物氨基酸序列中潛在的T細胞表位。
?
系統掃描蛋白質的一級結構,計算可以與HLA結合的9-15mer表位并評分。在藥物開發階段,減少從苗頭化合物(Hits)到候選藥物(leads)數量,同時減少將來進入臨床的候選藥物的潛在T細胞表位,降低臨床試驗中ADA的發生。
?
單純靠HLA親和力進行預測,會大大高估T細胞表位數量,需要考慮更多的因素,如
?
影響9-15?mer氨基酸序列成為功能T細胞表位的因素:
?
- HLA分子形成復合物的穩定性
- APC對于表位的自然處理
- 序列-MHC-II槽特定的CD4+T細胞的存在
?
HLA結合序列不能成為T細胞表位的其他因素:
?
-
親和力太低,無法引起免疫反應,
-
陰性選擇已經清除了特定的T細胞,
-
Treg介導的外周耐受。
MHC洗脫肽結合質譜分析獲得基礎數據,再對算法系統進行教育,使其獲得判斷T細胞功能表位的能力。
?
有一些相關技術被開發:
- MixMHC2pred:集成了等位基因特異性基序,肽長度和結合核心偏移偏好,使用超過99000個獨特的洗脫肽,進行MoDec分析(一個新的肽深度基序反褶積概率框架)。
- MARIA:基于多模態遞歸神經網絡算法,包括肽序列、基于側翼殘基預測信息的切割分數和HLA結合分數,兩者都來自新的預訓練神經網絡。Maria還包括基因表達水平,這是其特有的。
- MAPTAC:基于HLA-II等位基因純化結合肽,通過LC/MS分析肽序列,預測腫瘤HLA-II結合肽。
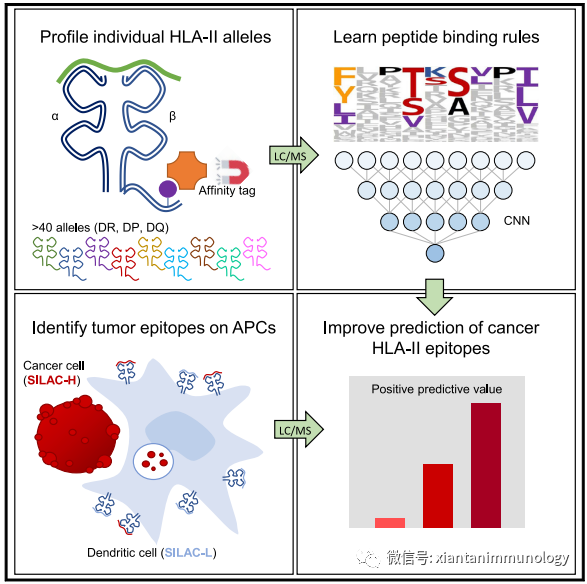
?Immunity2019,51,766–779
- NNAlign_MAC:MHCII相關肽蛋白質組學(MAPPs)結果與免疫表位數據庫(IEDB;http://www.iedb.org)收集的傳統親和數據的整合,提供HLA結合評分,預測藥物CD4+T表位。
?
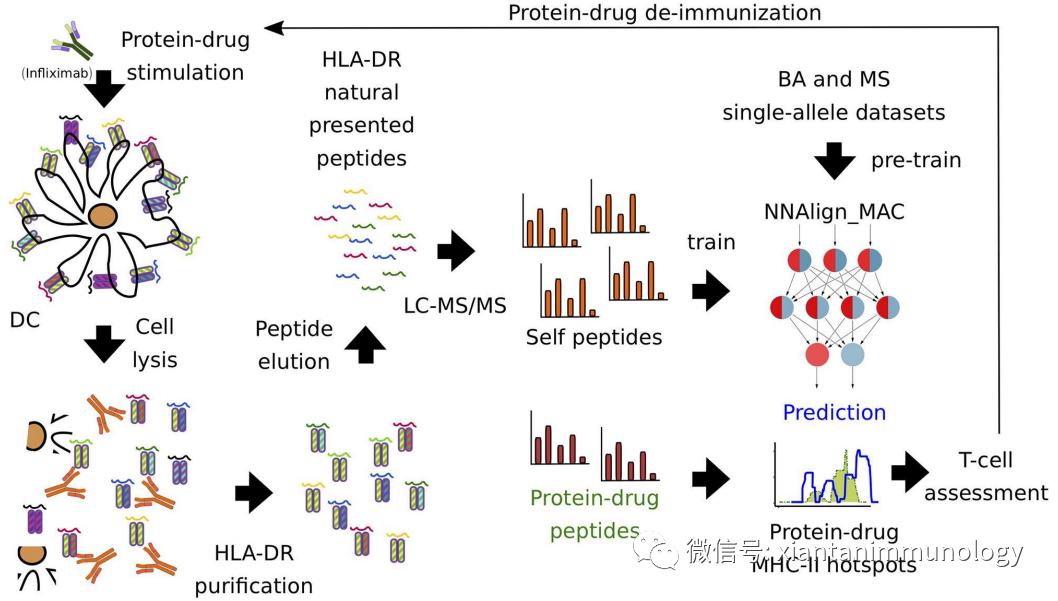
NNAlign_MAC?蛋白質藥物(英夫利昔單抗)免疫肽譜分析Front?Immunol. 2020;11:1304.
上述方法有特定的應用場景,且沒有整合ADA的臨床檢測數據,因而不可以盲目使用。
?
免疫細胞功能實驗
?
1. DC細胞成熟試驗
?
可以激活DC等APC細胞,是預測生物藥產生ADAs的指標之一。監測DC細胞成熟可以作為監測藥物免疫原性的工具。
moDC可以通過幾種方式生成。從人血液中分離PBMCs后,用磁珠分選單核細胞。加入GM-CSF和IL-4,誘導純化單核細胞分化為不成熟moDCs。
?
使用生物藥攻擊moDCs,監測攻擊后15分鐘到48小時的細胞參數:
?
- 4-48小時,檢測細胞表面標記物表達(至少包括CD83、CD80、CD86和CD40)
- 24-48小時,檢測細胞培養上清細胞因子分泌(IL-1β、IL-6、IL-8、IL-10、IL-12和TNF)
- 15-30分鐘,參與DC成熟的信號通路蛋白的磷酸化,如Akt,ERK1/2和Syk,
- 早期(6-24小時)mRNA定量細胞因子和/趨化因子
對照組設定
?
- 陰性(單獨培養基)
- 陽性對照(KLH、脂多糖(LPS)滴定或成熟雞尾酒激活劑)
- 一個低免疫原性(如貝伐單抗)和一個中高免疫原性(如ATR-107)標準參照
對結果的評估取決于所使用的方法,通常涉及對至少10個捐贈者的統計分析。DC激活細胞表面標記物增加50%或100%。
?
2. T細胞功能試驗
?
體外T細胞活化試驗,試圖通過測量CD4+T細胞對藥物T細胞結合結構域的活化情況,評估治療性蛋白和多肽的免疫原性風險。
?
T細胞功能檢測通常由四個不同的成分和順序步驟組成:1)抗原攻擊、2)細胞培養成分和刺激、3)檢測結果讀出、4)數據分析
?
試驗的關鍵點
?
1)抗原攻擊
?
抗原劑量/濃度
- 不會導致細胞毒性的優化量/濃度;
- 幼稚T細胞-樹突狀細胞和巨噬細胞相互作用以及隨后的激活是抗原劑量依賴性的
- 供體間EC50抗原的可變性(100倍或更多),需要誘導最大增殖的50%
?
對于記憶/回憶反應
單次攻擊就足夠了;攻擊后24-72小時細胞因子讀數,第7天的增殖讀數。
?
對于初始反應
產生抗原特異性T細胞需多個連續抗原攻擊;孵育時間可能在7到28天之間變化。
?
抗原作用模式
基于抗原性和靶點作用,細胞和檢測形式將發生改變。
?
2) 細胞培養成分
?
- 培養基:RPMI, DMEM, Earle’s modified
- 血清:AB血清、自體血清、無血清
- 刺激抗原
- 細胞因子:IL-2, IL-6, IL-7, IL-12,IL-15, IL-17, IL-21(考慮:劑量、時間點、持續時間)
- 用于DC成熟的細胞因子:IL-4、GM-CSF和LPS,減少旁觀者T細胞反應,并使用IFN-α減少背景
- 外源性刺激:LPS、TNF-α、IFN-α、CD40L、成熟雞尾酒刺激未成熟樹突狀細胞
?
3)結果讀取
?
ELISPOT 和 Fluorospot:多重檢測,根據細胞因子譜分析Th亞型。是短期記憶T細胞分析的理想選擇,可以識別記憶T細胞的低頻T細胞前體。
T細胞增殖:
T細胞活化的標記物;熒光標記物(如CFSE);DNA增殖標記物和Ki67的細胞內染色;最適合延長刺激時間以產生初始T細胞反應。
使用基于流式細胞術分析:細胞表面標記物如CD154(表明抗原特異性CD4T細胞活化)或細胞內細胞因子染色(作為T細胞活化的標記物)
利用Luminex?和MSD等平臺分泌細胞因子panel
?
3. B細胞功能分析
?
評估特定生物藥品激活CD4+T細胞的潛力,它們激活B細胞,并誘導其分化為產生ADA的漿細胞。
?
B細胞表位和產生生物藥品特異性IgG的B細胞數量,是免疫原性風險的重要標準。然而,免疫原性風險評估中的B細胞成分目前被大大忽視了,主要受限于體外評估B細胞的技術。
?
B細胞表位
?
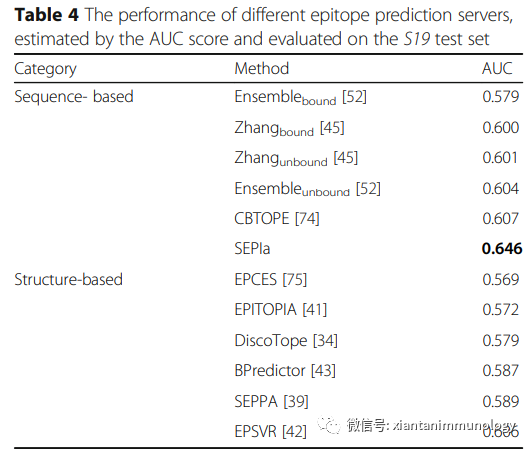
生物信息學預測方法已經被開發,如SEPIa,一種結合了13種不同序列衍生特征的算法,包括氨基酸組成、親水性、溶劑可及性和主鏈靈活性。研究發現,SEPIa的性能優于基于序列和基于結構的現有方法,但與T細胞表位預測相比,仍然有局限。
?
產生特定IgG的B細胞數量
迄今為止,只有基于ELISpot/FluoroSpot的檢測方法,被報道用于體外評估生物藥品特異性IgG-B細胞。它用PBMCs進行實驗,報告分泌靶抗原特異性抗體的B細胞的數量。
?
該實驗通過用激活雞尾酒(通常至少包含一種TLRs激動劑和IL-2)啟動B細胞,將記憶B細胞分化為漿細胞。
這些漿細胞分泌大量的抗體,可以被捕獲在PVDF膜上,可通過兩種不同的方式進行:
1)靶抗原可直接固定在PVDF膜上,并與分泌的抗體結合,該抗體可使用標記的抗Fc抗體進行檢測和定量;
2)使用抗Fc抗體捕獲B細胞衍生漿細胞分泌的所有抗體;通過比色或熒光檢測進行檢測和定量。后一種方法的優點是,抗體分泌細胞的總數可以與抗原特異性分泌細胞的數量一起確定,并能夠計算記憶B細胞群中抗原分泌細胞的頻率或百分比。該檢測程序也可以修改以檢測各種抗體類型(IgA、IgE、IgG1-4和IgM)。
目前僅限于評估記憶B細胞反應,但B細胞ELISpot/FluoroSpot試驗可以成為一種工具,以評估和比較在生物藥品開發的早期階段,未使用藥物的健康供體中是否已存在交叉反應抗體?
?
目前還沒體外模型可用于幼稚B細胞,由于涉及類別轉換的復雜過程,從低親和力IgM的產生轉換為與ADA反應相關的高親和力IgG抗體。
?
模型動物
?
標準的動物模型不合適免疫原性研究,因為任何人類治療蛋白都可能被識別為外源性蛋白。
?
人源化HLA轉基因小鼠表達人類MHC基因,因此可以有一個更接近人類T細胞庫。但這些模型主要用于研究具有已知風險等位基因的自身免疫疾病,在免疫原性預測方面的價值有限,因為它們不能反映人類群體中MHC等位基因的多態性,而TCR庫仍然完全是小鼠。
?
目前,最好的模型是人源化小鼠(即Human Immune System,“HIS”),通過對免疫缺陷小鼠進行骨髓消融,并用從胎兒肝臟或從臍帶血(更常見)中獲得的人類造血干細胞重建而產生。到目前為止,因為成本高、時間周期長,人源化小鼠還沒成為臨床前免疫原性風險評估的首選平臺,集中在具有高免疫原性風險的生物療法的研究/評估上。
?

參考文獻
- Abelin et al., Defining HLA-II Ligand Processing and Binding Rules with Mass Spectrometry Enhances Cancer Epitope Prediction, Immunity2019,51,766–779
- Barra C, Ackaert C, Reynisson B, Schockaert J, Jessen LE,
Watson M, Jang A, Comtois-Marotte S, Goulet J-P, Pattijn S,
et al. Immunopeptidomic data integration to artificial neural networks enhances protein-drug immunogenicity prediction. Front
Immunol. 2020;11:1304. doi:10.3389/fimmu.2020.01304. - Dalkas GA, Rooman M. SEPIa, a knowledge-driven algorithm for
predicting conformational B-cell epitopes from the amino acid
sequence. BMC Bioinform. 2017;18(1):95. doi:10.1186/s12859-
017-1528-9. - Axel Ducret, Chloé Ackaert, Juliana Bessa, Campbell Bunce, Timothy Hickling,
Vibha Jawa, Mark A. Kroenke, Kasper Lamberth, Ana?s Manin, Hweixian L. Penny, Noel Smith,
Grzegorz Terszowski, Sophie Tourdot & Sebastian Spindeldreher (2022) Assay format diversity
in pre-clinical immunogenicity risk assessment: Toward a possible harmonization of antigenicity
assays, mAbs, 14:1, 1993522
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/8448.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃