T-charge快速生產工藝介紹
體外延長T細胞培養期會耗盡與提高抗腫瘤功效相關的初始和干細胞記憶T細胞(Tscm)亞群的CAR-T最終產物。YTB323是一種以CD19為導向的自體CAR-T細胞療法,制造過程大大簡化,消除了培養周期長等復雜性。這種改進的T-Charge?工藝保留了T細胞干性,這是與治療潛力密切相關的重要特征,從而增強了CAR-T細胞的擴增能力和更強的抗腫瘤活性。
T-charge快速生產工藝方法
新的T-Charge?制造平臺在臨床前環境中進行了評估,該平臺將離體培養時間縮短至約24小時,制造最終產品的時間不到2天。T細胞從健康供體白細胞分離中富集,然后用慢病毒載體激活和轉導,該載體編碼用于tisagenlecleucel的相同CAR。培養約24小時后,收獲、洗滌和配制細胞(YTB323)。同時,使用傳統的體外擴增CAR-T制造方案(TM工藝)從相同的健康供體T細胞和相同的慢病毒載體生成CAR-T細胞(CTL*019)。制造后,CAR-T產品在免疫缺陷NSG小鼠(NOD-scid IL2Rg-null)的體外和體內T細胞功能測定中進行了評估,該小鼠接種了前B-ALL細胞(NALM6)或DLBCL細胞線(TMD-8)以評估抗腫瘤活性和CAR-T擴增。
T-charge快速生產的試驗結果
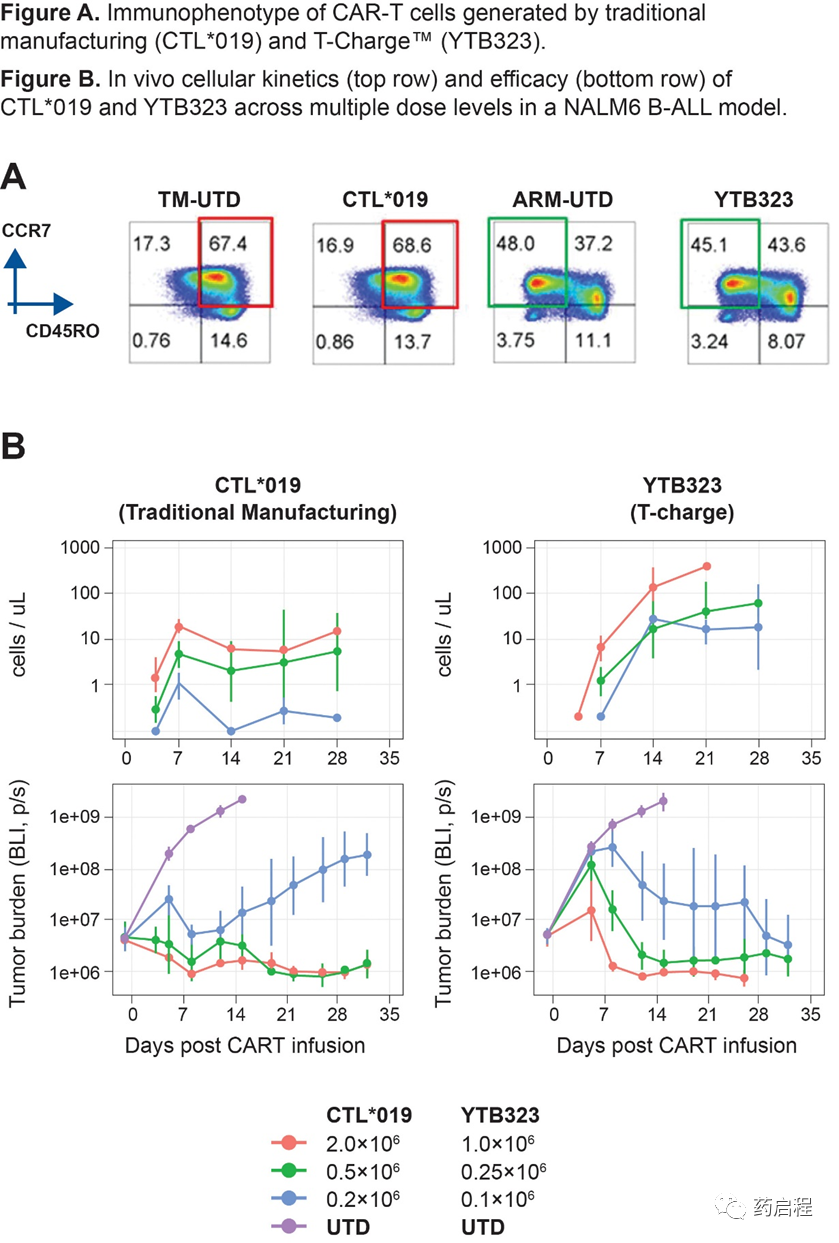
YTB323 CAR-T產品,通過這種新型無擴展制造工藝生產,保留了輸入白細胞分離術的免疫表型;具體而言,如流式細胞術所示,保留幼稚/Tscm細胞(CD45RO-/CCR7+)。相比之下,體外擴增的過程產生的最終產物主要由中央記憶T細胞 (Tcm) (CD45RO+/CCR7+) 組成(圖 A)。
大量和單細胞RNA測序實驗說明了支持保留初始表型的進一步證據,比較了使用T-Charge?協議生成的CAR-T的白細胞分離術和最終產物。
?YTB323 CAR-T細胞效力在體外使用細胞因子分泌試驗和腫瘤重復刺激試驗進行評估,旨在測試細胞產物的持久性和耗竭。與CTL*019相比,CD19特異性激活后,YTB323 T細胞的IL-2和IFN-γ分泌水平高出10到17倍。
此外,YTB323細胞能夠以低30倍的效應物:腫瘤細胞比率控制腫瘤,并且在重復刺激試驗中至少再進行7次刺激。兩種測定都清楚地證明了YTB323 CAR-T細胞在體外的效力增強。
YTB323細胞效力的最終臨床前評估是通過與CTL*019比較,在多劑量免疫缺陷NSG小鼠模型中對B細胞腫瘤的體內擴增和抗腫瘤功效。每周通過流式細胞術分析血液中CD3+/CAR+ T細胞的擴增,持續長達4周。YTB323和CTL*019均觀察到劑量依賴性擴增(Cmax和AUC 0-21d)。與多個劑量的CTL*019相比,YTB323的Cmax高≈40倍,AUC0-21d高≈33倍。觀察到與CTL*019相比,YTB323 的峰值擴增(T max)至少延遲1周,這支持了擴增的增加是由YTB323分化程度較低的T細胞表型驅動的。與CTL*019所需的0.5×106 CAR+細胞相比,YTB323 在0.1×106 CAR+細胞的較低劑量下控制NALM6 B-ALL腫瘤生長(圖 B)。在 DLBCL模型TMD-8中,只有YTB323能夠控制腫瘤,而CTL*019在各個劑量組導致腫瘤進展。YTB323細胞以較低劑量控制腫瘤的這種能力證實了它們的穩健性和效力。
用于YTB323的新型制造平臺T-Charge?被簡化、縮短且無需擴展。因此,它保留了T細胞干性,與改進的體內CAR-T擴增和抗腫瘤功效相關。與獲批的CAR-T療法相比,YTB323有可能在各自較低的劑量下實現更高的臨床療效。T-Charge?旨在徹底改變CAR-T制造,同時提高長期深度響應的可能性。
T-Charge制造的細胞的臨床試驗
這項I期、多中心、劑量遞增研究(NCT03960840)正在評估YTB323在B細胞惡性腫瘤患者中的安全性和初步療效。這里展示的結果集中在DLBCL隊列上。符合條件的患者是入組時患有可測量疾病、ECOG 0-1和r/r DLBCL在≥2線先前治療(包括自體造血干細胞移植(aHSCT)后)的成人。患者接受了劑量水平1(DL1;1-2.5×106 CAR+細胞)、DL2(5-12.5×106 CAR+細胞)或DL3(25-40×106 CAR+細胞)的單劑量YTB323。YTB323之前的橋接治療是可選的。主要終點是前28天的劑量限制毒性(DLT)發生率和確定推薦的II期劑量(RP2D)的安全性。次要終點是細胞動力學、當地研究者評估的總反應率 (ORR)、反應持續時間和總生存期。
T-Charge制造的細胞的臨床試驗結果
截至2021年4月16日,15名r/r DLBCL患者輸注了YTB323:DL1時4人,DL2 時10人,DL3時1人(圖,DL1和DL2的n=14)。中位年齡為65歲;大多數(60%)接受過2線治療,4人(27%) 接受過aHSCT。無論研究藥物關系如何,都報告了所有不良事件。
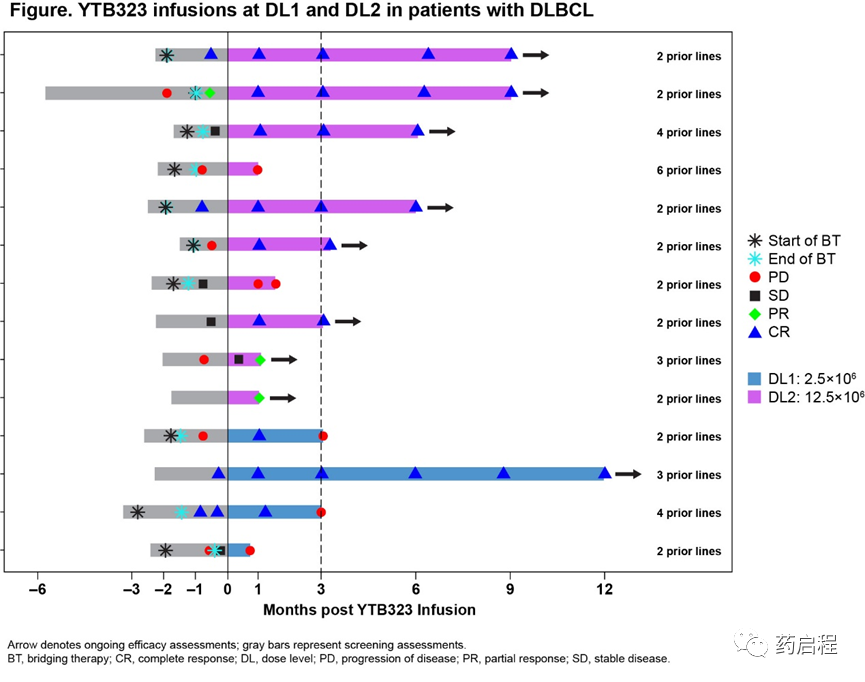
在可評估安全性的15名患者中,4名患者(27%)報告了至少1次3級(Gr) AE,6名(40%)報告了至少1次4級AE,2名(13%)報告了至少1次5級AE。最常報告的Gr3/4 AE是血小板減少癥(n=2, 13%)、中性粒細胞減少癥(n=3, 20%)和中性粒細胞計數減少(n=3, 20%)。7名患者(47%)有神經系統AE,其中2起事件 (13%)被認為是嚴重的-Gr3周圍神經病變(不相關)和Gr2癲癇發作(免疫效應細胞相關神經毒性綜合征3級,與治療)。4名患者(27%)經歷了細胞因子釋放綜合征(CRS),其中3名 (20%)Gr1/2和1(7%)名4(Lee et al, 2014)符合DLT 標準。分別有2例(13%)和1例(7%)患者使用托珠單抗和皮質類固醇治療 CRS。試驗中有4例死亡,均與YTB323無關:2例死于疾病進展,2例死于敗血癥(DL1時1例,DL3時1例)。DL1至CRS發病的中位時間為9天(范圍,9-9天),DL2為11天(范圍,8-17天)。觀察到初步的劑量依賴性反應。在DL1時,有4名患者在Mo3時可評估療效,ORR和CR率均為25%(95%CI,0.6%-80.6%)。在 DL2時,有8名患者在Mo 3時可評估療效,其中2名患者在輸注YTB323之前處于 CR中;ORR和CR率均為75%(95% CI,34.9%-96.8%)。
在CD3+細胞中13.6% CAR+或32,100拷貝/μg DNA的DL2處輸注后,觀察到劑量依賴性擴增(Cmax 和AUC 0-28d)。盡管長期持續性尚無法評估,但在DL2的8名患者中,進行3個月的隨訪,其中3名通過流式細胞術檢測到CAR表達(≥1%)。峰值擴張時間 (Tmax) 與峰值細胞因子水平 (輸注后約16天) 一致。YTB323的新型制造方法允許在最終產品中保存CD4和CD8幼稚/Tscm細胞,如流式細胞術所確定。批量和單細胞RNAseq分析表明YTB323保留了幼稚的干細胞樣表型(臨床試驗資料:CYTB323A12101).
DL3正在進行YTB323招募;RP2D仍有待確定。在DL2,YTB323顯示出有希望的療效和良好的安全性。當前數據支持在r/r DLBCL pts中繼續開發YTB323。
1、Preservation of T-Cell Stemness with a Novel Expansionless CAR-T Manufacturing Process, Which Reduces Manufacturing Time to Less Than Two Days, Drives Enhanced CAR-T Cell Efficacy
2、A First-in-Human Study of YTB323, a Novel, Autologous CD19-Directed CAR-T Cell Therapy Manufactured Using the Novel T-ChargeTM?platform, for the Treatment of Patients (Pts) with Relapsed/Refractory (r/r) Diffuse Large B-Cell Lymphoma (DLBCL)
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/8266.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃