#01
介紹
– Introduction –
嵌合抗原受體T細胞 (CAR-T) 療法是一種新型癌癥治療方法,包括通過抗體樣融合蛋白將體外擴增的T細胞重定向到腫瘤細胞表面表達的B細胞表位。表達CAR的轉基因被整合到制造過程中患者或供體來源的 T 細胞的基因組;主要使用重組逆轉錄病毒載體,盡管非病毒方法也相關。藥效學效應不受人類白細胞抗原 (HLA) 限制,并且不需要抗原呈遞或內源性或疫苗啟動的抗腫瘤 T 細胞所需的 T 細胞引發-細胞反應。CAR技術提供了一種機制,可用于免疫治療破壞由于低突變負荷、免疫編輯或HLA分子突變作為免疫逃逸途徑而導致內在 T 細胞免疫原性較差的腫瘤。
因此,這些新療法可以用于治療對免疫檢查點抑制單克隆抗體 (mAb) 不敏感的腫瘤表型,并代表了快速擴展的免疫腫瘤治療選擇工具箱的重要武器。CAR-T應用代表了一系列療法,這是開發時的一個重要考慮因素本文討論的質量控制和安全策略。
分子生物學
CAR介導的腫瘤靶向通常是通過細胞外結合部分實現的;通常是單鏈可變片段 (scFv),包含來自合適的小鼠單克隆抗體的輕鏈和重鏈的克隆可變區(圖 1)。積累的數據表明,人源化或全人源 scFv 可能會降低抗藥免疫原性的風險,從而在臨床活性和安全性方面帶來好處。
增強的結合親和力也可以提高活性,尤其是對于低密度靶點,但風險增加了腫瘤外免疫病理學。一種靈活的蛋白質,通常包含源自CD8α 或免疫球蛋白 Fc 域的序列,將抗原結合部分連接到跨膜和細胞內信號域。由于 CAR-T 獨立于抗原呈遞細胞運作,并且可能在充滿共抑制信號的腫瘤微環境中,最初的 CAR 方法僅依賴基于CD3ζ免疫受體酪氨酸的激活基序來激活目標連接后的 T 細胞,但在臨床上表現不佳。后代,例如當今試驗中的CAR-T療法,使用CD28和/或4-1BB共刺激結構域來增強CD3ζ部分。細胞外靶向部分和細胞內信號傳導成分的優化是應用研究的一個活躍且重要的領域。
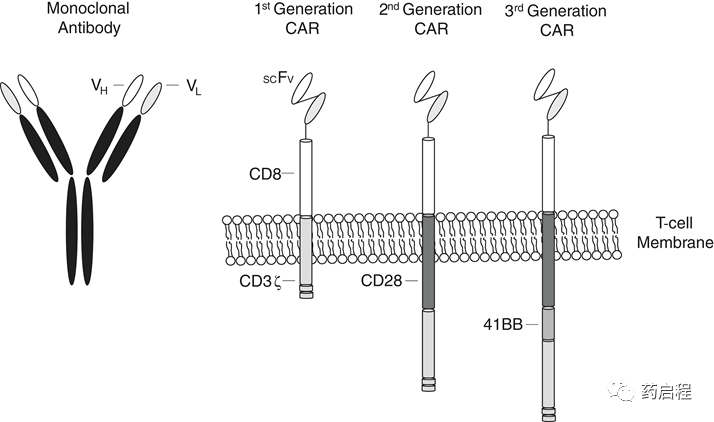
圖1 典型的CAR結構和細胞內信號結構域的演變。
臨床前評估(推薦閱讀參考文獻34-41)
臨床前階段關口包括驗證CAR-T特異性和效力;主要使用體外系統。基于動物的實驗通常僅限于評估免疫功能低下小鼠模型中的CAR-T 功能。由于物種特異性,常規臨床前PK和毒理學研究(為小分子療法的首次人體評估提供信息和支持所需的類型)的用途有限。可以說,需要新的和改進的臨床前模型來提供有關候選安全性和有效性的轉化相關信息?。改進模型以了解和預測不良反應,例如細胞因子釋放綜合征 (CRS),這是一種常見的臨床并發癥。?
#02
產業化生產和檢測放行
–Manufacturing and Release?–
背景與挑戰
人們希望通過提高制造能力和降低商品成本來增加患者獲得CAR-T 療法的機會。開發針對實體瘤類型的新CAR-T療法也是一個優先事項。良好生產規范(GMP ) CAR-T 療法的合規制造比許多其他生物藥物更具挑戰性,主要是由于細胞成分的復雜性和可變性增加以及載體介導的基因工程步驟的重要性。αCD19 CART-T療法的已發布信息表明高達10%的制造運行通常會失敗。這是設置易于處理的產品規格的重要考慮因素,以確保質量并允許臨床試驗和制造過程優化中的可比性。最終產品質量與可測量的分子和細胞相關與臨床活動相關的特征。因此,了解作用機制對于定義關鍵的產品質量屬性(如效力)至關重要。如果沒有這些信息,為制造過程和材料優化分配質量目標配置文件是具有挑戰性的。闡明支持 αCD19 CAR-T 活性的機制原理一直很困難,因為多因素和潛在相關的產品和患者特異性因素可能是體內活性的原因。?
臨床前模型存在缺陷,治療的成本和有限的可用性進一步縮小了治療范圍。生成足夠強大的臨床生物標志物數據集來提供這些信息。歐洲監管機構最近發布了 ATMP 的 GMP 指南,其中專門解決了其中一些問題。指南文件概述了基于風險的評估方法,并傳達了有關 ATMP 化學、制造和控制的某些要素所需的詳細程度將增加通過開發階段的產品進展逐步增加。盡管如此,監管復雜性和制造挑戰代表了將實驗室規模實驗轉化為關鍵臨床試驗和市場準備的可擴展過程的重要“能量駝峰”。
流程和優化
盡管存在一些復雜性,但每位患者的整體制造方案大致相似(圖 2);涉及 CAR 轉基因離體插入,然后是大規模 T 細胞擴增和過程結束制定。輔助組件,例如細胞因子、培養基、病毒載體、抗體包被的磁珠,必須有分析證書并符合GMP驗收標準。由于CAR-T產品制造的“及時”性質和潛在的狹窄機會窗口患者治療、供應鏈中斷都會產生很大的影響。提高良好生產規范 (GMP) 質量載體、細胞因子、抗體和其他關鍵試劑的供應鏈彈性和互操作性將有助于制造組織。提供合適的細胞系、檢測、標準和參考材料來支持這一點現在被認為是我們公司和其他地方的一個重要目標。
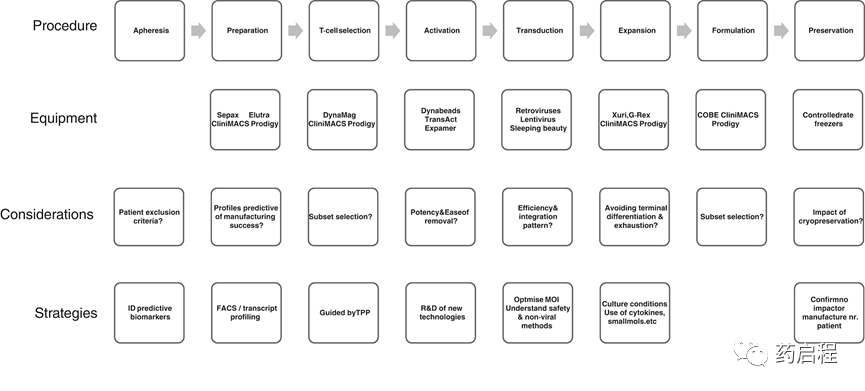
?
細胞原料
大多數CAR-T制造方法利用通過白細胞去除術從患者身上提取的自體T細胞。循環腫瘤細胞數量增加,并用免疫調節藥物進行大量預處理,導致不典型的循環免疫細胞特征和功能。單采產品可能含有足夠濃度的這些元素,以影響制造過程。了解與制造成功或失敗相關的細胞原材料概況是制造商的一個重要目標。在整個CAR-T制造過程中應用現代多色流式細胞術監測免疫細胞譜是一種策略。選擇使用更通用和標準化的細胞起始材料有幾個優點;具有顯著降低制造成本、提高可重復性和擴大患者可及性的范圍。
基因編輯技術的到來意味著同種異體來源可能會變得更加常規,因為這些技術可用于破壞甚至替代編碼潛在同種異體抗原的基因。基因編輯方法還可以提高可重復性和效力。最近的一篇論文描述了將CAR靶向傳遞到 TRAC 基因座,從而將CAR表達置于內源性 T 細胞啟動子的控制之下并消除 T 細胞受體的表達。這避免了強直性CAR信號傳導并防止了T細胞耗竭,導致顯著更高的持久性并在低得多的劑量下降低變異性。其他人已經消除了抑制性受體,例如程序性死亡 1 (PD-1)。基因編輯在適當應用于CAR-T療法制造時可能會成為一項關鍵的使能技術。了解脫靶效應的潛力和影響現在應該是指導技術戰略和監管的當務之急。生物信息學和全基因組測序是根本重要的工具,應該用于調查和控制;補充甚至替代動物研究。
實驗性多能干細胞衍生的 T細胞底物的最新發展為該領域提供了另一種潛在的前進方向。盡管這一概念很有吸引力,但現階段仍未完全解決對基因組不可預測性和相關致瘤性風險的擔憂。了解與“安全”誘導的多能性相關的轉錄組學特征,結合改進的受控轉基因插入方法,可能會推進“合成”T 細胞令人興奮的可能性。然而,自體細胞來源的技術和安全挑戰可能仍然存在CAR-T療法的中流砥柱,至少在中短期內如此。
T 細胞選擇和激活
提供安全有效的細胞療法取決于了解和指定與目標產品概況相關的特定細胞群。T 細胞激活和擴增可以使用磁珠或涂有抗CD3和CD28 mAb的聚合物來實現,稱為人工抗原呈遞細胞。在介導有效 T 細胞擴增的同時,通過這些信號通路的長期刺激可以驅動分化并最終衰老:幾項研究表明,分化程度較低的中央記憶(CD45RO+、CD62L+、CD95+)和干(CD45RA+、CD62L+、CD95+)記憶 T 細胞亞群在代謝特征、持久性和功效方面更勝一籌。在 CAR-T 制造過程中豐富或促進這些細胞群可能會改善患者的預后。最近的工作表明,在 T 細胞擴增階段與IL-7和IL-15共培養可能有助于實現這一目標。
表達CAR的轉基因的整合
γ-逆轉錄病毒載體是第一個用于CAR-T制造的轉基因整合策略,并受益于高轉導效率和易于獲得且可擴展的包裝策略。慢病毒載體的優勢在于它們有效地轉導非分裂細胞和分裂細胞,盡管規模生產具有挑戰性但并非不可克服。問題主要與水泡性口炎G蛋白介導的細胞融合以及多質粒轉染方法的產量限制有關。穩定包裝細胞系的構建,例如 Sanber 等人描述的原型,可以提高慢病毒載體的制造能力。與 γ 逆轉錄病毒相比,慢病毒也可能因其較低的基因毒性潛力而受到青睞。現有證據表明,γ 逆轉錄病毒介導的整合有利于轉錄起始位點,而慢病毒沒有顯示出比其他位點增加的傾向。然而,這遺傳毒性的理論風險仍然存在,并且被認為會隨著每個細胞轉基因插入數量的增加而放大。開發針對基因組安全港的載體和其他靶向整合方法將進一步降低風險。
符合GMP的病毒載體生產非常昂貴,目前生產能力不足。更便宜、更容易獲得的替代基于病毒載體的轉導將非常有益。基于轉座子的技術,如睡美人,已成功用于 CAR-T 制造。轉座是通過包含轉座子和轉座酶的基于質粒的載體的共電穿孔來完成的。轉座酶與轉座子編碼的轉基因兩側的反向末端重復序列結合,導致隨機基因組整合。使用非病毒方法生產的CAR-T產品是否與病毒載體介導的轉基因整合生產的產品一樣安全和有效仍有待研究通過正在進行的臨床研究的讀數來證實。
運營管理
生物制藥公司銷售的CAR-T治療產品最近獲得批準反映了對復雜 ATMP 制造可擴展性的吸引力和樂觀情緒。制造已經從主要由研究人員主導的利用通用設備和基礎設施的制度化活動發展為更加自動化和封閉的系統基于設備的進程。
從本質上講,存在兩種操作“模型”,可用于未來具有成本效益的商業規模制造 (i) 流程方法,通常用于制造大規模生產的商品類型。在 CAR-T 療法制造的背景下,患者的細胞進入一個合格的“生產線”,該“生產線”分為上述各種制造工藝步驟。每一步都需要定制的基礎設施,需要訓練有素的操作員,并且需要嚴格的線路清理協議來保證每個個性化產品的完整性。細胞擴增發生在數天到數周內,必須在工藝結束前在物理劃分的單元中進行。這種模式適用于集中制造方法,細胞起始材料和最終的可能是冷凍保存的產品在不同的患者治療中心之間來回運輸。(ii) 以設備為中心。在這種設置中,專用設備或多或少地致力于制造患者的 CAR-T 產品。多個獨立運行的設備可以放在一起,并由相對較少的勞動力進行監控,他們在系統出現故障時實施預先計劃的補救措施。由于較低的人員配備水平和潔凈室的嚴格性,這種方法很靈活,并且可能更具成本效益。它適用于更加分散的方法,可能在地理上與專門的患者治療中心和專門的分析測試能力位于同一地點。無論采用何種操作模型系統,穩健可靠的數據管理和良好的分發實踐對于確保患者特定組織和治療產品的保管至關重要。?
過程控制和釋放測試
生產轉基因細胞療法需要大量的過程中和質量控制測試。釋放測試對于確認制造的醫藥產品的身份、純度、安全性和效力至關重要(表 1)。質量控制測試對于自體CAR-T療法尤其繁重,因為每個個性化產品“批次”都必須進行測試。及時性對于避免CAR-T 產品在輸注或冷凍保存前降解至關重要。測試通常涉及復雜的分析,這些分析可能不適合自動化或高通量操作方式。
制造商強調缺乏合適的標準、參考材料和性能控制來確保測試的重現性和互操作性。在與臨床療效和安全性相關的分子和細胞特征方面仍然存在關鍵知識差距。當代多參數的應用和不可知的生物標志物策略,適用于免疫腫瘤學其他領域的類型,應該有助于識別與臨床活動相關的更相關的關鍵質量屬性。同樣,隨著長期臨床安全經驗的增加,有可能改進或編輯某些測試,例如遺傳穩定性,但需獲得監管部門的批準。?

安全
內毒素、支原體、多余的輔助成分和CD3陰性雜質的水平必須在嚴格定義的符合性限制內。微生物安全是CAR-T產品和一般細胞療法的一個重要問題,因為制造過程與傳統的腸胃外藥物相比,它們的條件要少得多。確保源材料的無菌性可能存在問題,最終產品的滅菌不適用。常規的無菌測試方法可能對基于細胞的產品不太敏感;例如,樣品的無菌性可能無法確保整個輸液產品和標準無菌測試方案的無菌性,例如微生物生長培養基接種可能無法檢測到所有潛在的污染物。原則上,極低的殘留細菌負荷會在儲存和運輸過程中擴大。基于生長的微生物控制的新方法以及快速細菌檢測的新方法是有必要的,并且EDQM已經開發了細胞治療制劑的快速微生物測試指南。
目前的要求是檢查主細胞庫、生產終止細胞、載體濃縮物和離體轉導的 T 細胞是否有復制病毒;盡管迄今為止沒有證據表明第三代慢病毒構建體可以在任何測試的輸注 T 細胞產品中獲得復制能力。還需要有關每個基因組的整合載體拷貝、整合概況和整合位點的信息。工作包含具有明確載體拷貝數和插入位點的深度表征細胞系的WHO標準的制定和可用性將非常有利于確保制造質量,并有助于控制長期臨床安全性研究。
純度和鑒別
FACS分析是評估表型特征和CAR表達的當前選擇方法,作為純度和身份的衡量標準。現在,提供代表確定細胞表型的合適抗體和標準化制劑是提高細胞計數器和分析實驗室測量標準化的優先事項。美國國家生物標準與控制研究所 (NIBSC) 的生物治療學部已經生產了CE標記的熒光染料標記的T細胞亞群,并且正在開發類似的材料以支持跨生命科學的基于細胞儀的測量。
盡管對于常規表征非常有價值,但熒光激活細胞分選 (FACS) 分析僅限于基于先驗知識和試劑可用性選擇的相對少量參數。質譜流式細胞術和其他先進的多路復用技術是強大的工具,現在可用于識別可監測的其他表型標記,以改進制造和質量控制過程。
推而廣之,大規模并行技術在這一領域具有實用性是合乎邏輯的。單細胞RNA測序 (scRNA-seq) 是一項新興技術,可用于對異質免疫細胞群中不同T細胞亞群的無偏分子表征。scRNA-seq可應用于CAR-T制造和作用機制為標準化提供信息的研究。具體而言,RNA-seq可用于識別與目標產品特征相關的轉錄組特征,即增殖、持久性、抗腫瘤效應子功能和安全性。
效力測試
根據cGMP指南,效力是用于確認批次間一致性、穩定性和質量的重要參數。評估通常涉及一種或多種生物測定,這些測定測量與產品作用機制內在相關的生物活性的某些方面。CD19 CAR-T療法的效力測試主要是通過測量對靶標細胞系的細胞溶解活性來實現的或CAR-T與表達CD19的細胞系共同孵育后的IFN-γ分泌,即假定與體內抗腫瘤活性相關的短期效應子功能。然而,這種類型的生物測定給出了整個細胞系的平均讀數。效應細胞群并且不考慮 T 細胞功能的全部潛在多樣性。多重單細胞方法的可用性將極大地幫助細胞免疫療法的輸注前評估,這些現在正在出現。
基于短期效應器功能的讀數與整體CAR-T效力的相關性也值得懷疑。Kunkele等人證明,在測量特異性裂解和細胞因子分泌的測定中產生最高活性的CAR-T構建體在體內表現出減弱的抗腫瘤效力。與此一致的是,越來越多的臨床生物標志物數據表明,改善的結果與具有增強的擴增潛力 (Cmax) 和αCD19 CAR-T的輸注有關輸注后持久性 (AUC)。
免疫學法則以及表型和轉錄組分析數據支持以下論點:較少分化的中樞記憶(CD45RO+、CD62L+、CD95+)和多能干細胞(CD45RA+、CD62L+、CD95+)記憶 T 細胞亞群在這方面可能是最佳的。
Fraietta 等人研究了41名接受 Kymriah 治療的慢性淋巴性白血病 (CLL) 患者的生物標志物。持久緩解與早期記憶 T 細胞的轉錄組學特征相關,而來自無反應患者的 T 細胞富含屬于已知終末分化和衰竭途徑的基因。因此,FACS顯示CD8+ T細胞群中CD27+ CD45RO-細胞的頻率與對該療法的完全和持久反應顯著相關。無反應者在注入的 CAR-T 細胞上具有更高水平的 T 細胞耗竭標志物,并降低了CD27表達。對輸注的CD8 細胞上PD1和CD27表達的聯合評估有助于準確預測臨床反應,因此,可能代表 αCD19 CAR-T 產品質量控制的有用測量參數,增殖試驗還可以增加細胞因子釋放或殺傷評估。
#03
討論
–?Dicussion?–
迄今為止,CAR-T療法在幾種難治性血液癌癥中提供了令人印象深刻的客觀反應率,但代表了一系列復雜的不同治療工具,需要仔細評估以監測其安全性和有效性。生物制藥公司銷售的CAR-T治療產品最近獲得批準反映了對復雜細胞治療制造可擴展性的吸引力和樂觀情緒。雖然兩種基于CAR的產品已根據現有知識和流程獲得批準,更廣泛的患者訪問和開發用于更常見癌癥類型的CAR-T療法是當務之急。封閉式和自動化生產單元的開發一直是制造的重大進步,但由于新興的監管環境,符合GMP的制造本質上具有挑戰性、細胞成分的異質性以及載體介導的基因工程和 T 細胞擴增步驟的重要性。每批的釋放測試是繁重的,并且在許多情況下設定制造成功標準很復雜,因為標準化本身就很困難,但應該是必不可少的組成部分;如果設計得當。
從成功的αCD19 CAR-T方法中獲得的知識在實體瘤CAR-T療法臨床開發中的更廣泛適用性在現階段仍不清楚。可能需要不同的目標產品概況來解決非液體癌癥。現代多參數和不可知生物標志物策略的應用,以及應用于免疫腫瘤學其他領域的類型,應改善CAR-T產品關鍵質量屬性與與癌癥陽性臨床結果相關的生物效應器功能的聯系。同樣,臨床數據現在可以與深度剖析的輸液材料相關聯,以告知質量目標產品的概況。因此,將開發產品質量控制檢測的小組與臨床生物標志物小組進行互操作是合乎邏輯的。這也可以為患者選擇標準提供信息或支持伴隨診斷的開發,這是考慮到CAR-T 療法和ATMP的潛在成本的一個關鍵目標。
Cell therapy products: focus on issues with
manufacturing and quality control of chimeric
antigen receptor T-cell therapies
10.1002/jctb.5829.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/7787.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃