來源:生物谷
CAR-T(Chimeric Antigen Receptor T-Cell Immunotherapy),即嵌合抗原受體T細胞免疫療法。該療法是一種出現了很多年但近幾年才被改良使用到臨床中的新型細胞療法。在急性白血病和非霍奇金淋巴瘤的治療上有著顯著的療效,被 認為是最有前景的腫瘤治療方式之一。正如所有的技術一樣,CAR-T技術也經歷一個漫長的演化過程,正是在這一系列的演化過程中,CAR-T技術逐漸走向成熟。
這種新的治療策略的關鍵之處在于識別靶細胞的被稱作嵌合抗原受體(chimeric antigen receptor, CAR)的人工受體,而且在經過基因修飾后,病人T細胞能夠表達這種CAR。在人體臨床試驗中,科學家們通過一種類似透析的過程提取出病人體內的一些T細胞,然后在實 驗室對它們進行基因修飾,將編碼這種CAR的基因導入,這樣這些T細胞就能夠表達這種新的受體。這些經過基因修飾的T細胞在實驗室進行增殖,隨后將它們灌注回病人體內。這些T細胞利用它們表達的CAR受體結合到靶細胞表面上的分子,而這種結合觸發一種內部信號產 生,接著這種內部信號如此強效地激活這些T細胞以至于它們快速地摧毀靶細胞。
近年來,CAR-T免疫療法除了被用來治療急性白血病和非霍奇金淋巴瘤之外,經改進后,也被用來治療實體瘤、自身免疫疾病、HIV感染和心臟病等疾病,具有更廣闊的應用空間。基于此,針對CAR-T 細胞療法取得的最新進展,小編進行一番盤點,以饗讀者。
1.Cell子刊:新研究在開發利用現成的HSC-iNKT細胞療法治療癌癥方面取得重大進展
doi:10.1016/j.xcrm.2021.100449
如今,在一項新的研究中,來自美國加州大學洛杉磯分校的研究人員在開發一種“現成的”癌癥免疫療法方面邁出了關鍵的一步,這種癌癥免疫療法使用罕見但強大的免疫細胞,有可能大量生產、長期儲存并安全地用于治療各種癌癥患者。相關研究結果發表在2021年11月16日的Cell Reports Medicine期刊上,論文標題為“Development of allogeneic HSC-engineered iNKT cells for off-the-shelf cancer immunotherapy”。
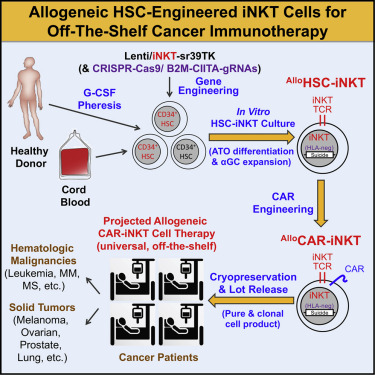
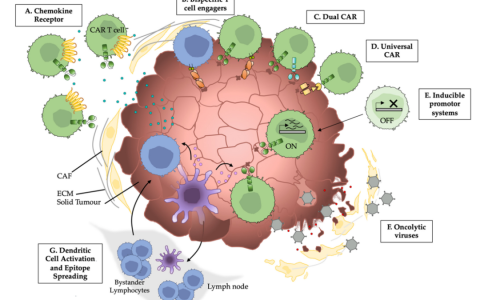
圖片來自Cell Reports Medicine, 2021, doi:10.1016/j.xcrm.2021.100449。
Yang團隊首先使用基因工程對造血干細胞進行編程,使之更有可能產生iNKT細胞,由此產生的iNKT細胞被稱為HSC-iNKT。接下來,這些經過基因改造的造血干細胞被放置在模擬胸腺環境的人工胸腺類器官中,其中胸腺是一種專門的器官,在那里T細胞在體內自然成熟。在這種人工胸腺類器官8周后,每個造血干細胞平均產生10萬個iNKT細胞。
Yang和她的合作者隨后測試了所產生的HSC-iNKT細胞,并比較了它們的抗癌能力與那些稱為自然殺傷細胞(NK細胞)的免疫細胞的抗癌能力。他們發現,在實驗室培養皿中,HSC-iNKT細胞在殺死多種類型的人類腫瘤細胞—包括白血病、黑色素瘤、肺癌、前列腺癌和多發性骨髓瘤細胞—方面明顯優于NK細胞。
Yang團隊接下來為HSC-iNKT細胞配備了一種用于一些免疫療法中的稱為嵌合抗原受體(CAR)的特定分子,從而使之能夠識別和殺死特定類型的癌癥。在這種情況下,他們在HSC-iNKT細胞中加入了靶向在多發性骨髓瘤細胞表面上發現的一種蛋白的CAR,然后測試了這些細胞對抗移植到小鼠體內的人類多發性骨髓瘤腫瘤的能力。這些配備了CAR的HSC-iNKT細胞消除了多發性骨髓瘤,而且接受這種治療的小鼠在一生中都沒有腫瘤,也沒有出現移植物抗宿主病等并發癥的跡象。
2.Clin Cancer Res:新研究表明TCR-T細胞有望用于治療惡性腦瘤
doi:10.1158/1078-0432.CCR-21-1881
在一項新的研究中,來自德國癌癥研究中心(DKFZ)和海德堡大學曼海姆醫學院的研究人員首次利用小鼠的實驗模型成功測試了一種用于治療惡性腦瘤的新抗原特異性轉基因免疫細胞療法。相關研究結果于2021年11月15日在線發表在Clinical Cancer Research期刊上,論文標題為“T cell receptor therapy targeting mutant capicua transcriptional repressor in experimental gliomas”。
Bunse和他的團隊利用一種實驗性小鼠模型,如今首次證明了靶向腫瘤新表位的轉基因T細胞可用于治療膠質瘤。利用一種預測模型,Bunse和他的團隊確定了CIC蛋白(capicua transcriptional repressor)的一個片段作為T細胞攻擊的一個有希望的靶標結構;所有膠質瘤中約有2%顯示出這種蛋白的頻發突變。
接種這種CIC新表位(一種疫苗肽)的小鼠形成了一個激活的輔助性T細胞群體,它們在對這種疫苗肽的反應中表現出高度的激活。這些作者利用特別活躍的T細胞來分離負責表位識別的T細胞受體(TCR)編碼基因。他們隨后將分離出的TCR基因轉移到T細胞中,從而能夠在培養皿中培育出大量的“轉基因”T細胞(TCR-T細胞),這些T細胞都具有相同的、高度活躍的靶向這種CIC新表位的TCR。為了研究這些TCR-T細胞的療效,他們將它們直接注射到患膠質瘤小鼠的腦室中。與放療相結合,這種T細胞療法導致了一些小鼠的膠質瘤遭受免疫排斥。
3.Front Immunol:揭示CAR-Treg細胞有望用于解決移植耐受挑戰
doi:10.3389/fimmu.2021.686439
美國南卡羅萊納醫科大學霍林斯癌癥中心研究員Leonardo Ferreira博士因他在調節性T細胞(Treg)方面的開創性工作而備受矚目。近期,他和他的合作者在Frontiers in Immunology期刊上發表了一篇標題為“Precision Engineering of an Anti-HLA-A2 Chimeric Antigen Receptor in Regulatory T Cells for Transplant Immune Tolerance”的論文,描述了他利用表達嵌合抗原受體(CAR)的Treg細胞(CAR-Treg)解決移植耐受挑戰的經驗。
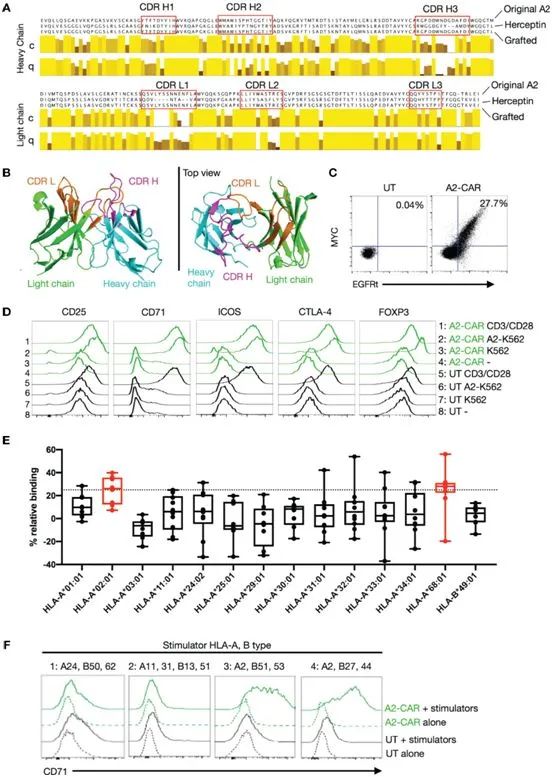
?
產生嫁接的A2-CAR,圖片來自Frontiers in Immunology, 2021, doi:10.3389/fimmu.2021.686439。
Ferreira說,這篇論文中描述的研究是首批使用一種名為CRISPR-Cas9的基因編輯方法精確設計CAR-Treg細胞的研究之一。這種方法就像用手術刀精確地去除Treg 細胞的原始TCR,然后在其位置上插入CAR。這種方法更安全,因為它確保只有一個CAR拷貝存在,并且CAR的調節方式與原始TCR相同。
具體而言,Ferreira及其團隊描述了一種抗HLA-A2的CAR(A2-CAR),它是通過將人類單克隆抗HLA-A2抗體的互補性決定區域(CDR)嫁接到赫賽汀4D5單鏈可變片段的框架區域,并與CD28-ζ信號結構域融合而產生的。CDR嫁接的A2-CAR保持了原始抗體的特異性。
然后,他們通過CRISPR/Cas9剔除人類Treg細胞的內源性TCR并使用慢病毒轉導引入A2-CAR,或使用同源介導的修復(homology-directed repair, HDR)將CAR構造體直接整合到TCR α恒定位點,從而產生HLA-A2單特異性人類CAR-Treg細胞(A2-CAR-Treg)。這些缺乏TCR的人類A2-CAR-Treg細胞在體外保持Treg細胞的表型和功能。
此外,缺乏TCR的A2-CAR-Treg細胞有選擇地在移植自HLA-A2轉基因小鼠或已故人類供者的HLA-A2+胰島(即表達HLA-A2的胰島)中積累。它們沒有損害這些HLA-A2+胰島的功能,而類似的缺乏TCR的A2-CAR+ CD4+傳統性T細胞在不到2周的時間內就排斥了HLA-A2+胰島。缺乏TCR的A2-CAR-Treg細胞只有在存在由共同轉移的外周血單核細胞或受者小鼠表達的HLA-A2的情況下才會延遲移植物抗宿主病。
4.J Clin Oncol:靶向CD19-CAR治療效果與何種因素有關?揭秘于影響因子高達44.5的最新研究!
doi:10.1200/JCO.21.01405
盡管CD19靶向治療取得了較好的結果,但復發仍是一個嚴重問題。在Tisagenlecel的臨床試驗中,達到CR的患者的24個月無復發生存率(RFS)為62%。無論是CD19-CAR還是Blinatumomab,復發的常見機制是靶抗原的下調或逃逸。鑒于CD19調控的潛力,連續靶向CD19可能會增加無反應或復發的風險。由于擔心CD19陰性逃逸、復發風險和CD19-CAR無反應以及增加使用Blinatumomab和CD19-CAR等問題,近段時間Regina M Myers教授及其團隊針對此類問題進行了相關研究,試圖評估Blinatumomab暴露與后續CD19-CAR治療結果之間的關系。研究人員對2012年至2019年間接受CD19-CAR治療的復發或難治性ALL的兒童和年輕患者進行了多中心回顧性研究。主要研究終點是6個月無復發生存期(RFS)和無事件生存期(EFS),根據Blinatumomab的治療方案進行分層。次要目標包括比較長期生存結果,完全緩解率,CD19調節和識別與EFS相關的因素。
420例患者中有77例(18.3%)之前接受過Blinatumomab治療。與未使用過Blinatumomab的患者相比,暴露于Blinatummab的患者更頻繁地出現KMT2A重排。在可評估CD19-CAR反應的患者中(n = 412),Blinatumomab無反應的患者對CD19-CAR的完全緩解率(20 / 31,64.5%)低于blinatumomab有反應的患者(39 / 42,92.9%)或blinatumomab初發患者(317 / 339,93.5%)。在CD19-CAR治療后,Blinatumomab無應答者6個月的EFS更差(27.3%;95% CI, 13.6 ~ 43.0)。
5.Science子刊:敲除DNMT3A基因可以阻止T細胞衰竭,增強CAR-T細胞的抗腫瘤反應
doi:10.1126/scitranslmed.abh0272
嵌合抗原受體(CAR)T細胞(CAR-T)療法是一種免疫療法,正在為一些血癌、實體瘤和慢性病毒感染的患者帶來臨床上的變化。在一項新的研究中,來自美國圣猶大兒童研究醫院的研究人員如今確定了一種表觀遺傳程序如何驅動T細胞衰竭(T-cell exhaustion)。他們的研究顯示了敲除DNMT3A基因如何重新激活CAR-T細胞反應,這對目前測試這種治療方法的下一代臨床試驗有影響。相關研究結果發表在2021年11月17日的Science Translational Medicine期刊上,論文標題為“Deleting DNMT3A in CAR T cells prevents exhaustion and enhances antitumor activity”。
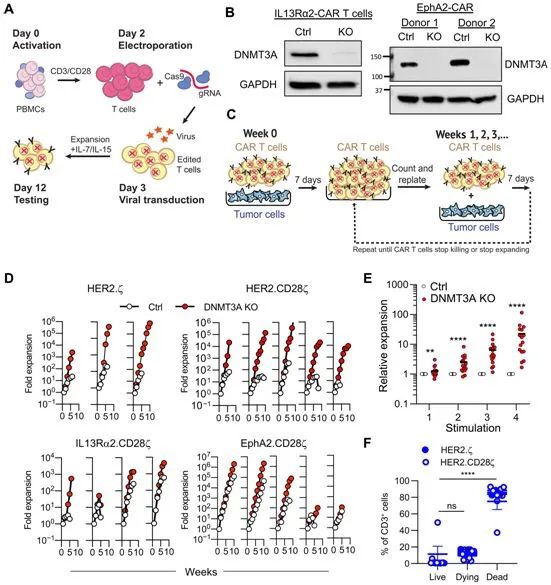
DNMT3A的缺失增強了CAR-T細胞在體外重復刺激過程中的擴增。圖片來自Science Translational Medicine, 2021, doi:10.1126/scitranslmed.abh0272。
雖然臨床試驗已顯示,CAR-T細胞療法有可能為某些疾病提供持久的反應,但這種療法可能因T細胞衰竭而受到很大限制。然而,剔除CAR-T細胞中的DNMT3A 基因(編碼DNA甲基轉移酶3α)普遍保留了它們攻擊癌細胞的能力。
論文共同通訊作者、圣猶大兒童研究醫院骨髓移植與細胞治療系的Giedre Krenciute博士說,“當對CAR-T細胞進行基因改造使之特異性識別和攻擊腫瘤時,它們有潛力比化療或放療等傳統療法更有效和更安全。通過評估不同實體瘤模型中靶向一系列腫瘤抗原的人類CAR-T細胞,我們發現確實敲除DNMT3A是有效的,無論我們靶向哪種腫瘤類型或抗原。這突出了DNMT3A在控制人類CAR-T細胞功能方面的核心作用,我們很高興在未來將我們的方法轉化為早期階段的臨床測試。”
6.Science子刊:新方法改善CAR-T細胞的抗原敏感性
doi:10.1126/scisignal.abe2606
嵌合抗原受體(CAR)旨在模擬激活的內源性T細胞受體(TCR)并誘導對腫瘤抗原的細胞毒性反應。然而,TCR對腫瘤抗原的敏感性至少是CAR的100倍。這意味著CAR需要比TCR更多的腫瘤抗原來激活,從而導致許多患者被排除治療或治療失敗和疾病復發。
為了設計具有較低激活閾值的CAR,或者說具有更好的抗原敏感性的CAR,來自美國弗雷德-哈金森癌癥研究中心等研究機構的研究人員直接比較了原代人類T細胞中的TCR和CAR信號傳導。全局磷酸化蛋白質組分析顯示,關鍵的T細胞信號蛋白—比如構成了T細胞輔助受體的一部分的CD3δ、CD3ε和CD3γ,以及TCR銜接蛋白LAT—在CAR刺激下要么不被磷酸化,要么只被弱磷酸化。相關研究結果近期發表在Science Signaling期刊上,論文標題為“Comparative analysis of TCR and CAR signaling informs CAR designs with superior antigen sensitivity and in vivo function”。
這些作者利用他們獲得的磷酸化蛋白質組數據設計了BB/εPRS_ITAM/ζ CAR和BB/ζ/link_GRB2 CAR。與BB/ζCAR相比,這些新的CAR設計在體外有更高的抗原反應性,但不如28/ζCAR敏感。BB/εPRS_ITAM/ζ CAR的敏感性提高被CD3ε PRS和ITAM結構域的突變所取消,這意味著信號傳導是功能改善的機制。
這些新設計的CAR能夠更好地與CD3ε和LAT結合,導致在低密度抗原環境下增強體外T細胞激活,并改善在淋巴瘤、白血病和乳腺癌體內模型中的療效。這些研究結果為設計更有力地激活T細胞輔助受體和銜接蛋白的新型CAR提供了依據,從而使CAR-T細胞在細胞培養物中對低抗原密度的腫瘤細胞作出更有效的反應,并減少小鼠體內的腫瘤負荷和死亡率。
這些新設計的CAR沒有一種可以接近天然TCR的敏感性,這說明TCR屬性的重要性,如降低親和力、連續觸發、機械刺激感受器功能和輔助受體結合,這些屬性都很難被設計到CAR構造體中。
然而,在血液惡性腫瘤和乳腺癌的四種異種移植小鼠模型中,這些新設計的CAR與BB/ζ CAR相比,具有同等或更好的抗腫瘤活性。此外,在三種血液學惡性腫瘤模型中,這些新設計的CAR比28/ζCAR更有優勢,這與抑制性受體的較少上調和較好的持久性相吻合。因此,這些磷蛋白組學數據使得這些作者能夠設計出具有更好的體外抗原敏感性和體內功能的新型CAR。
7.Nature:重大進展!開發出新型CAR-T細胞,可以靶向識別以前無法靶向的癌癥驅動因子
doi:10.1038/s41586-021-04061-6
在一項新的研究中,來自美國費城兒童醫院的研究人員在治療侵襲性實體癌方面取得了突破性進展:他們開發出一種新的癌癥治療方法,該方法靶向腫瘤細胞內對腫瘤的生長和生存至關重要的蛋白,但是在此之前這種靶向是不可能實現的。利用大型數據集和先進的計算方法的力量,他們能夠識別出呈現在腫瘤細胞表面上的肽,并且能夠用“以肽為中心(peptide-centric)”的嵌合抗原受體(peptide-centric chimeric antigen receptor, PC-CAR)T細胞(PC-CAR T細胞)靶向它們,其中PC-CAR T細胞是一類新的經過基因改造的T細胞,可刺激免疫反應,消除腫瘤。這一發現為用免疫療法治療更廣泛的癌癥以及在更大比例的人群中應用每種療法打開了大門。相關研究結果于2021年11月3日在線發表在Nature期刊上,論文標題為“Cross-HLA targeting of intracellular oncoproteins with peptide-centric CARs”。論文通訊作者為費城兒童醫院兒科腫瘤學家John M. Maris博士。
這些作者將MHC分子從神經母細胞瘤細胞表面上分離出,并確定哪些肽是存在的,其豐度如何。他們利用Maris實驗室產生的一個大型基因組數據集,確定哪些肽是神經母細胞瘤所特有的,而不是由正常組織表達的。他們優先考慮了那些來自于對腫瘤至關重要的基因并具有激活免疫系統所需特征的肽。為了剔除任何可能與正常組織有交叉反應的潛在抗原,他們根據正常組織上的MHC肽數據庫對剩余的腫瘤肽進行了過濾,去除了任何與正常組織中的親本基因有關的肽。
利用這種多組學方法,這些作者確定了一種未突變的神經母細胞瘤肽,它來自PHOX2B,而PHOX2B是一種神經母細胞瘤依賴性基因和轉錄調節因子,之前已被費城兒童醫院鑒定和表征。下一個主要障礙是開發一種能特異性識別該肽的PC-CAR,該肽占肽-MHC復合物的2%~3%。通過與抗體發現公司Myrio Therapeutics合作,他們開發出靶向這種肽的PC-CAR,并證實這些PC-CAR能識別這種呈現在不同HLA類型上的腫瘤特異性肽,這意味著該療法可能能夠適用于不同遺傳譜系的患者。
在這項研究的基礎上,這些作者在小鼠身上測試了表達PC-CAR的T細胞(即PC-CAR T細胞),并發現這種治療方法導致了神經母細胞瘤腫瘤的完全消除和靶向消除。
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/7390.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃