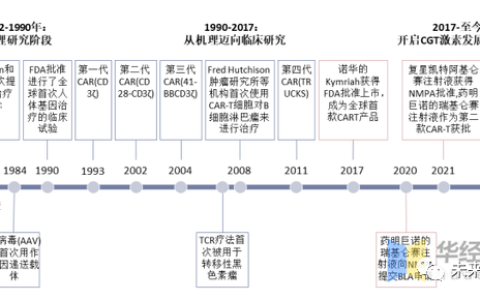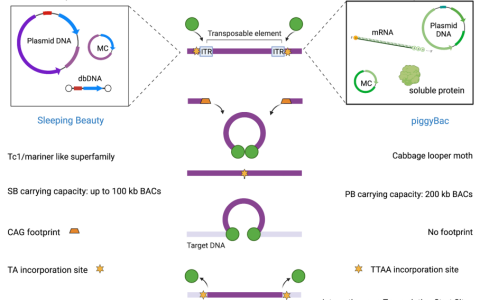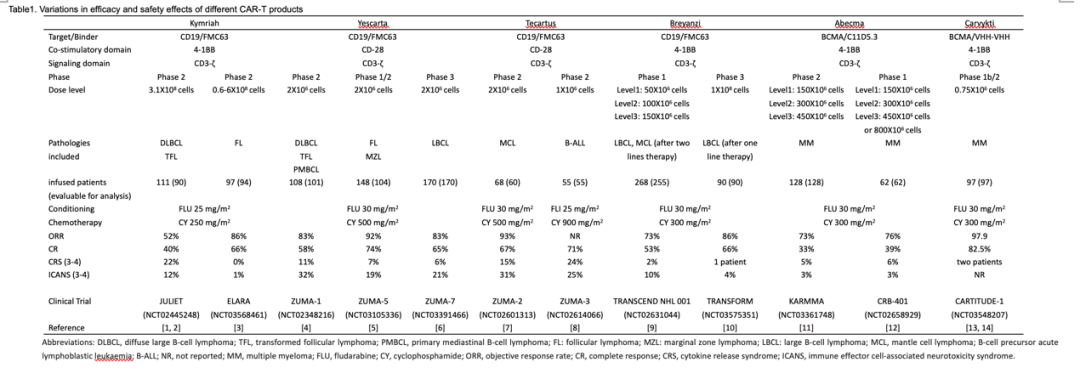
針對惡性血液腫瘤經(jīng)FDA批準(zhǔn)上市的CAR-T產(chǎn)品效果及安全性分析 | 圖片來源:The journey of CAR-T therapy in hematological malignancies
首款獲批上市的CAR-T細(xì)胞療法:Kymriah(Tisagenlecleucel) Kymriah是首個獲得PDA批準(zhǔn)也是全球第一款獲批上市的CAR-T細(xì)胞療法,用于治療難治性或第二次或更晚復(fù)發(fā)的25歲以下的B細(xì)胞前體急性淋巴細(xì)胞白血病(B-ALL)患者,獲批時間為2017年8月31日,因此2017年被認(rèn)為是“CAR-T細(xì)胞治療元年。” 之后,2018年5月2日,Kymriah獲批用于治療成人復(fù)發(fā)/難治性大B細(xì)胞淋巴瘤(R/RLBCL),包括彌漫性大B細(xì)胞淋巴瘤(DLBCL)、濾泡性淋巴瘤(FL)引起的高級別B細(xì)胞淋巴瘤(HGBCL)和DLBCL。此次獲批是基于JULIET(NCT02445248)2期臨床試驗結(jié)果:接受治療的111名R/RLBCL患者,客觀緩解率(ORR)為52%,完全緩解率(CR)達到了40%,效果拔群;常見的不良反應(yīng)事件包括細(xì)胞因子釋放綜合征(CRS)和神經(jīng)毒性(ICANS),三級不良反應(yīng)發(fā)生率分別為22%和21%。 再之后,2022年5月27日,Kymriah再次獲得FDA批準(zhǔn),用于治療經(jīng)兩線或多線全身治療后的R/RFL成年患者,這是Kymriah獲批的第三個適應(yīng)癥。此次獲批是基于2期ElARA試驗(NCT03568461)結(jié)果,在接受治療后可評估的94名患者中,ORR達到86%,CR達到66%,未出現(xiàn)三級以上的CRS,有1%的患者出現(xiàn)三級以上的ICANS。 Kymriah可以說是CAR-T細(xì)胞療法“老大哥”,時至今日距離其上市已經(jīng)過去五年,新適應(yīng)癥的獲批也證實了其治療效果的不俗。 第二款上市的CAR-T細(xì)胞療法:Yescarta(AxicabtageneCiloleucel) 當(dāng)時的人們不會想到,第二款CAR-T細(xì)胞的上市會來得如此之快:時隔不到3個月,第二款CAR-T細(xì)胞療法Yescarta獲得審批上市。 2017年10月18日,Yescarta獲得FDA批準(zhǔn)用于治療經(jīng)過兩線或多線全身治療后復(fù)發(fā)的成人R/RLBCL,包括DLBCL、原發(fā)性縱隔B細(xì)胞淋巴瘤(PMBCL)、HGBCL和轉(zhuǎn)化濾泡性淋巴瘤(TFL)。此次獲批是基于ZUMA-1(NCT02348216)的臨床試驗結(jié)果:101名患者接受Yescarta輸注的患者,ORR和CR分別達到了83%和58%;三級以上CRS的發(fā)生率為11%,三級以上ICANS的發(fā)生率為32%。 此后于2021年3月3日,Yescarta斬獲第二項適應(yīng)癥,經(jīng)FDA批準(zhǔn)可用于經(jīng)兩線或多線全身治療后復(fù)發(fā)R/RFL成年患者。此次獲批是基于ZUMA-5(NCT03105336)的臨床試驗結(jié)果:接受治療的患者ORR為92%,CR達到了74%;三級以上CRS的發(fā)生率為7%,三級以上ICANS的發(fā)生率為10%。 之后Yescarta獲批了第三種適應(yīng)癥。2022年4月1日,Yescarta獲FDA批準(zhǔn)用于治療一線化學(xué)免疫治療成年R/RLBCL患者。此次獲批是基于ZUMA-7(NCT03391466)臨床試驗結(jié)果:接受治療患者的ORR和CR分別為83%和65%,三級以上CRS的發(fā)生率為11%,三級以上ICANS的發(fā)生率為6%。 前兩款上市的CAR-T細(xì)胞均在后續(xù)的時間內(nèi)陸續(xù)獲批新的適應(yīng)癥,拓寬了CAR-T細(xì)胞療法的適應(yīng)范圍,值得一提的是:Yescarta也是中國最先獲得審批上市的CAR-T細(xì)胞療法,于2021年6月在中國獲批上市,商品名為奕凱達。而此次獲批距離其獲得FDA批準(zhǔn)上市時隔不到四年,中國的新藥審批速度可以說十分迅速(以往國外上市的新藥國內(nèi)上市往往需要近十年或者十幾年)。 第三款上市的CAR-T細(xì)胞療法:Tecartus(BrexucabtageneAutoleucel) 就在前兩款CAR-T細(xì)胞療法獲批讓人們認(rèn)為CAR-T細(xì)胞療法即將進入井噴時代時,隨之而來的卻是長達近三年的沉寂。直到2020年7月24日,第三款CAR-T細(xì)胞療法才姍姍來遲。基于2期臨床試驗ZUMA-2的臨床試驗結(jié)果,Tecartus獲得FDA批準(zhǔn)用于治療R/R套細(xì)胞淋巴瘤(MCL)患者。接受治療患者的ORR達到了93%,CR達到了67%。不過值得注意的是:Tecartus治療后三級及以上ICANS的發(fā)生率達到了31%,位于所有已經(jīng)獲批的CAR-T細(xì)胞療法之最。 此后2021年10月1日,FDA批準(zhǔn)Tecartus用于治療26歲及以上的R/RB-ALL成年患者,此次獲批是基于ZUMA-3(NCT02614066)的2期臨床試驗結(jié)果:結(jié)合治療患者的CR達到了71%;三級以上CRS的發(fā)生率為24%,三級以上ICANS的發(fā)生率為25%。 作為Yescarta的迭代版本,Tecartus不論是ORR還是CR都有所改善,但是不良反應(yīng)率也有所上升,如果可以有效地管理其治療毒性的話,Tecartus有望成為更強大、更好的、理想的血液腫瘤治療藥物。 第四款上市的CAR-T細(xì)胞療法:Breyanzi(LisocabtageneMaraleucel) 第四款CAR-T細(xì)胞療法的上市并沒有讓人等很久。2021年2月5日,Breyanzi(LisocabtageneMaralecel)(CD19/FMC63)獲得FDA批準(zhǔn),用于治療接受兩線或多線全身治療后的復(fù)發(fā)的R/RLBCL成年患者。此次獲批是基于 TRANSCENDNHL001(NCT02631044)的臨床試驗結(jié)果:接受治療的患者ORR和CR分別為73%和53%,接受治療后1年仍舊保持CR的患者為65%,治療效果十分持久。 這可能和Breyanzi不同的設(shè)計有關(guān):和其他CAR-T細(xì)胞治療產(chǎn)品相比,Breyanzi加入了一種特殊的受體(tEGFR,表皮生長因子受體),可以作為CAR表達的替代物;另外Breyanzi重新設(shè)計了回輸中不同T細(xì)胞亞群的比例,對T細(xì)胞的質(zhì)量進行了一輪控制,這些都有助于提升治療的CAR-T細(xì)胞的擴增能力,延長其治療的持久性。 此后,于2022年6月25日,Breyanzi獲得FDA批準(zhǔn)用于R/RLBCL患者更前一線的治療,此次獲批使得Breyanzi成為R/RLBCL患者中目前為止所有獲批CAR-T細(xì)胞產(chǎn)品中適應(yīng)范圍最廣的CAR-T細(xì)胞療法。此次獲批是基于2期PILOT試驗結(jié)果(NCT03483103)和關(guān)鍵的3期TRANSFORM試驗結(jié)果(NCT03575351),在TRANSFORM試驗中,接受治療的90名患者的ORR和CR分別達到了86%和66%,而三級以上CRS和ICANS的發(fā)生率僅為1%和4%。 作為后來獲批的CAR-T細(xì)胞療法,Breyanzi確實有其不同尋常之處。 第五款上市的CAR-T細(xì)胞療法:Abecma(IdecabtageneVicleucel) 第五款CAR-T細(xì)胞療法的上市有些與眾不同:和前四款CAR-T細(xì)胞療法相比,其最大的特點是不再選擇CD19靶點,而是選擇了另一個靶點BCMA,這也是其可以突圍上市的關(guān)鍵之一。 2021年3月26日,Abecma獲得FDA批準(zhǔn)上市,用于治療四線或更多療法之后的成人R/RMM患者。此次獲批是基于KARMMA(NCT03361748)的2期臨床研究結(jié)果,接受治療的患者ORR和CR分別達到了73%和33%,由于接受治療的患者已經(jīng)經(jīng)過多線治療,這一臨床試驗結(jié)果讓人十分驚喜。接受治療的患者三級及以上CRS的發(fā)生率5%,三級ICANS的發(fā)生率為3%,未發(fā)生三級以上的ICANS。 相對來說,盡管Abecma三級以上不良反應(yīng)的發(fā)生率有所改善,但是仍舊需要提升患者的CR,從而推動其獲批應(yīng)用于更多臨床患者的治療。 第六款上市的CAR-T細(xì)胞療法:Carvykti(CiltacabtageneAutoleucel) 第六款上市也是距離我們最近上市一款的CAR-T細(xì)胞療法,其引人注目的有兩個點:首先是它選擇的是BCMA靶點,是第二個獲批的BCMA-CAR-T細(xì)胞療法;另外一點則是因為其是一款中國原研生產(chǎn)的CAR-T細(xì)胞療法! 2022年2月28日,Carvykti獲得FDA批準(zhǔn)用于治療三線及以上治療后復(fù)發(fā)的進展性R/RMM成人患者,由于Carvykti的結(jié)構(gòu)域中添加了2個單域的VHH抗體(VHH-VHH),使得該種CAR-T細(xì)胞對于BCMA靶點有著非同尋常的親和力。從CARTITUDE-1(NCT03548207)臨床試驗結(jié)果來看,接受治療的患者ORR達到了驚人的97.9%!而嚴(yán)格完全緩解(sCR)也到達了82.5%!此外,在接受治療的97名患者中僅有兩名患者出現(xiàn)了三級或以上不良反應(yīng)。 從目前公布的數(shù)據(jù)來看,和Abecma這款首個針對BCMA靶點上市的CAR-T細(xì)胞療法相比,Carvykti顯然存在著更好的治療優(yōu)勢。 中國獲批的CAR-T細(xì)胞療法:RelmacabtageneAutoleucel(Relma-cel,JWCAR029) Yescarta是中國最先上市一款CAR-T細(xì)胞療法,目前中國共計有2款CAR-T細(xì)胞療法上市,另一款則是于2021年9月3日獲中國國家藥監(jiān)局(NMPA)批準(zhǔn)上市的Relmacabtagene Autoleucel,商品名為阿基侖賽。 在2期臨床試驗(NCT04089215)中,接受Relma-cel治療的59名患者的ORR和CR分別為75.9%和51.7%,三級以上CRS和ICANS的發(fā)生率均為5.1%。針對R/RLBCL患者,Relma-cel表現(xiàn)出了和Breyanzi相當(dāng)?shù)闹委熜Ч⑶蚁嚓P(guān)毒性水平低。 除了上面已經(jīng)獲得這些CAR-T細(xì)胞療法之外,自體BG1805(Anti-CLL1CAR-T)也被FDA授予治療急性髓系白血病(AML)的孤兒藥稱號。 在前沿的CAR-T細(xì)胞療法研發(fā)領(lǐng)域,中國已經(jīng)迎頭趕上,不論是研發(fā)還是審批速度均不遜色于國外,相信中國CAR-T細(xì)胞治療領(lǐng)域也將在未來的一段時間內(nèi)迎來新的增長。 CAR-T細(xì)胞療法已經(jīng)取得了如此不俗的治療進展,但是誰不想百尺竿頭更進一步呢?基于此,人們開始了新一輪提升CAR-T細(xì)胞療法治療效果的探索。在下一篇中,將為大家?guī)鞢AR-T細(xì)胞聯(lián)合療法的相關(guān)進展。
編輯:小果果,轉(zhuǎn)載請注明出處:http://www.448371.com/cells/myxb/21786.html
免責(zé)聲明:本站所轉(zhuǎn)載文章來源于其他平臺,主要目的在于分享行業(yè)相關(guān)知識,傳遞當(dāng)前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請及時告知,我們會在24小時內(nèi)刪除相關(guān)信息。
說明:本站所發(fā)布的案例均摘錄于文獻,僅用于科普干細(xì)胞與再生醫(yī)學(xué)相關(guān)知識,不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃