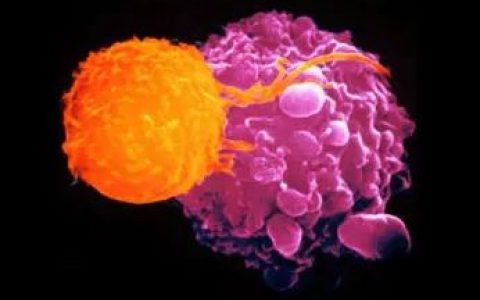
在我國,隨著癌癥發病率和病死率的增加,癌癥已成為國人死亡的主要原因。
據世界衛生組織(WHO)統計,2020年中國新發癌癥病例456.87萬例,其中男性247.59萬例,女性209.28萬例;2020年中國癌癥死亡病例300.28萬例,其中男性182.00萬例,女性118.28萬例。
2020年中國癌癥新發病例和死亡病例約占該年全球癌癥發病和死亡總數的23.7%和30.2%,均高于該年中國人口占全球人口總數的比例(18.6%)。
2020年中國新發病例和死亡人數均為全球第一,中國已經成為了名副其實的“癌癥大國”。
長期以來,腫瘤的免疫治療備受人們關注,腫瘤免疫治療的核心是激活人體免疫系統,依靠自身免疫功能的抗癌療法,而其中自然殺傷(natural killer,NK)細胞的擴增作為免疫治療手段,也開始受到人們的重視。NK細胞是機體抗腫瘤和抗感染的第一道防線,不需特異抗原的刺激,在免疫治療領域有較好的前景。
關注“干細胞與外泌體”公眾號了解更多
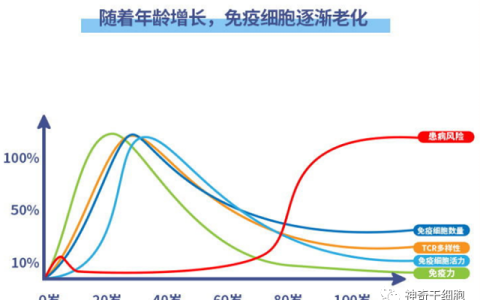
NK細胞作為淋巴細胞家族的重要成員,其在體內的衰減程度與腫瘤的惡性進展密切相關。
由于NK細胞對異常細胞的殺傷能力不需要任何抗原的刺激,并且不受HLA分子的限制,因此在腫瘤免疫治療領域顯示出強大的活力與優勢。
NK細胞通過啟動“自我缺失識別”和“應激誘導識別”功能,依賴顆粒釋放、 ADcc效應以及啟動凋亡信號發揮抗腫瘤作用。
腫瘤的發生、發展與機體免疫功能的失調密切相關,腫瘤免疫治療因其卓越的療效已逐漸成為繼手術、放療和化療后的第四類腫瘤治療方法。NK細胞是一群大顆粒淋巴細胞,在抗腫瘤免疫中發揮重要作用。
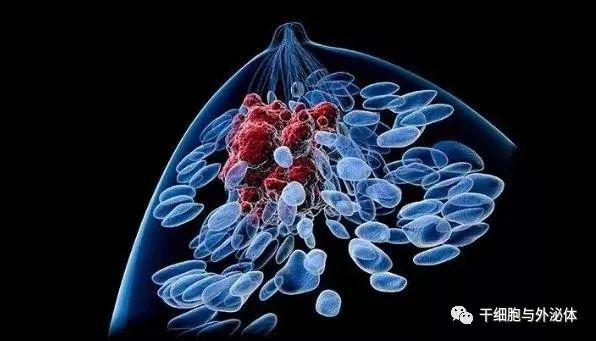
女性乳腺癌作為一種惡性腫瘤,對女性生命造成很大的威脅。
作為免疫細胞的NK細胞,以其不需要刺激就能直接殺傷腫瘤細胞的優勢,已用于多種腫瘤治療的研究。
不同晚期乳腺癌治療方案中,化學、放射、內分泌、靶向等療法有耐藥及對機體損害等局限性。為此免疫療法與其他療法聯合可能會產生較好的療效同時回避不足。
NK細胞殺傷腫瘤的機制?
NK細胞殺傷癌細胞可通過NK細胞分泌的細胞毒微粒將穿孔素和顆粒酶釋放至癌細胞間隙,顆粒酶經鈣離子和穿孔素共同參與形成的多聚穿孔素通道順利進到癌細胞,凋亡酶體系被激活;NK活化后與(FasL)和 Fas(CD95)、TNF-α與TNFR-I結合,胞漿內與凋亡有關的結構域改變,癌細胞的凋亡系統被啟動最終導致癌細胞凋亡;腫瘤特異抗體結合 NK 表面 CD16,癌細胞隨之被 NK 識別并殺傷;NK 分泌的趨化因子以 及細胞因子可激活下游的適應性免疫。
NK細胞和腫瘤微環境?
腫瘤的微環境中的白介素12、白介素15等細胞因子是調節NK細胞經常使用的因子,參與識別腫瘤細胞。
NK細胞作用于腫瘤細胞后對其微環境產生記憶,再次出現同類刺激時, 正常NK細胞會向記憶NK (NKm) 細胞轉化,后者會表達高水平的穿孔素、干擾素γ和顆粒酶分子;若腫瘤細胞表達抑制配體,NK重復出現于產生抗性的腫瘤中,會導致功能障礙,很難刺再激免疫效應。
最新研究NK不僅依賴于MHC-I識別, 還依賴于許多其他信號,提示有效能的NK細胞和相關信號通路可能是未來腫瘤治療的一種方向。
NK細胞與其他治療方案聯合在乳腺癌中的治療進展
NK細胞對腫瘤有無需刺激的直接殺傷,但腫瘤衍生物、 腫瘤誘導形成的基質細胞和腫瘤細胞本身常降低 NK 細胞對其殺傷。NK 的不斷發育、腫瘤的不斷發展,使腫瘤與 NK 之間的制約發生改變。
腫瘤萌芽時,被激活的NK受體識別, NK 被激活;在免疫發展控制時,NK 殺傷腫瘤依靠其自身 分泌細胞因子所強化的細胞毒作用,免疫后記憶性 NK 細胞 隨之產生,腫瘤細胞表面抗性分子在免疫過程中不斷表達產生抗免疫反應;NK 細胞長時間暴露于腫瘤環境中,其免疫效能弱化,腫瘤會逃逸免疫并發展轉移;然而在臨床實踐中NK 細胞依然顯示出應用潛力。
近年來,NK 細胞相關免疫治療可通過補充細胞因子、抗體介導免疫檢查點抑制、信號通路基因修飾、細胞過繼和聯合化放療等加強對腫瘤的殺傷。
這預示著 NK 細胞聯合其他治療方案在惡性腫瘤中擁有廣泛而有效的用途。
NK 細胞聯合細胞因子
細胞因子白介素2、白介素15 、18 和白介素12等可促使 NK 的發育和強化其細胞毒性能力,多種類型腫瘤中重組人IL-15 的安 全性被臨床實驗證實。
在臨床研究中,IL-15激動劑ALT-803與抗 PD-1 單克隆抗體聯合使用時顯示出較強的潛力,而不會增加嚴重的不良事件的發生率,異二聚體白介素15可加強腫瘤內的 NK 浸潤度,提高NK免疫的效率。
研究發現通過對三陰性乳腺癌細胞系MDA-MB-468、BT-549、Hs578T、IIB-BR-G 和 MDA-MB-231 的研究,用 IL-2 或 IL-15 處理 NK 效應細胞,結果與單獨的 NK細胞效應作用相比,針對同系靶細胞 IFN-γ 和 TNF-α 產生和NK 細胞脫顆粒均增加,這說明白介素 2 和 白介素 15 刺激增加了 NK 對 TNBC 細胞的毒性,刺激 NK 細胞脫顆粒和細胞因子的產生 IL-15 勝于 IL-2。
從犬外周血單核細胞中分離出CD5 – 細胞與 IL-2、IL-15 和 IL-21 共培養 K562 細胞,結果,NK細胞的表達NKp30、NKp44、NKp46、NKG2D、CD244、穿孔素、顆粒酶 B、和 TNF-α 高度上調。
此外研究表明,經過IL-12、IL-15 和 IL-18 預先處理過的 NK 細胞在腫瘤組織中抗腫瘤功能不衰減。因而可知 NK 和細胞因子一起使用可加強 NK 對 BC 的殺傷。
NK 聯合限制免疫檢查點藥物靶向治療
生理狀態下程序性死亡因子 -1(PD-1) 可以避免免疫細胞過度活化,人體內多種免疫細胞上都有表達,是免疫系統的保護性效應分子。BC 中 PD-L1 結合 T 細胞上的 PD-1,免疫應答受抑,癌細胞發生逃逸。
因此抑制 PD-1/PD-L1 通路,逆轉免疫抑制的腫瘤微環境,使被抑制的免疫系統重新激活,是治療乳腺癌的方法之一。
一項研究PD-L1陽性的晚期TNBC病人,用抑制免疫檢查點的藥物帕博利珠單抗治療,另一項研究對168位進展或晚期BC患者用單藥 Avelumab( 阿維魯單抗 ) 治療的效果進行了評估,兩項研究總緩解率、無進展生存 (PFS)、中位 OS 均明顯升高,患者臨床獲益率增加,PD-L1表達程度與治 療應答成正相關,而 Avelumab 在 非TNBC 亞組的療效,顯示臨床獲益較少。
對于 HER-2 陽性乳腺癌患者,抗 PD-1 抗體可以提高治療效果,提示免疫治療和抗 HER-2 靶向治療聯合的可獲益可能較大。阿替利珠單抗和抗 HER2 聯合治療,不論是療效還是安全均較好。
三陰性乳腺癌 (TNBC) 表達 PD-L1 的比例較非 TNBC 要高,PD-1/PD-L1 抑制靶向治療對 TNBC 耐受性更好,毒性更小,聯合治療療效可能更好 。
研究證明,TNBC 癌病人 PD-L1的表達主要在腫瘤浸潤免疫細胞上,并非直接在腫瘤細胞上表達。
因此,PD-1/PD-L1 通路在 BC 治療作用還需后續研究。
綜上所述 NK 免疫治療與限制免疫檢查點藥物結合靶向治療可能會讓乳腺癌病人獲益。
NK細胞聯合化療
三陰性乳腺癌尚無靶向療法,化療仍是主力治療,但其反應較短,需要多種方案共同參與才可能獲得更好療效。
三陰性乳腺癌免疫原性強,TILs浸潤較少、免疫標志物表達較低,單純免疫治療療效不佳。
因而,將 NK 免疫與化療結合,激活免疫表達,是三陰性乳腺癌患者取得臨床獲益的新方向。
化療可使腫瘤抗原暴露,激活 NK 表達,增強免疫正向調節,進而取得更好的抗腫瘤療效。
化療藥物影響免疫系統可能因藥物種類不同而不同:紫杉醇、蒽環類藥物可以激活相關受體活性增強樹突細胞活性,誘發腫瘤分泌 IFN 并激活 T 細胞。
吉西他濱能減少髓源性限制激活細胞,抑制 T 細胞的功效。
蒽環類和奧沙利鉑可以誘導宿主免疫原性細胞死亡和抗腫瘤免疫反應抑制腫瘤生長,要達到最佳的治療效果免疫活性必須完全激活,免疫力受損的患者顯然不能獲益。
單次使用CD96 抗體可促進 NK 細胞誘導抗轉移,當與多柔比星化療聯合使用時,抗轉移能力大大增強。
有的化療藥物使用后發現 NKG2D 配體的釋放增多,提示化療后 NK 對癌細胞的殺傷加強。可見免疫調節與化療結合起來共同治療乳腺癌,可能成為一種可靠的選擇。
NK 細胞聯合放射治療
放療和免疫治療可相互促進。對乳腺癌患者放療,可以引發癌細胞出現免疫原性死亡。
相關研究證明,放療可增加I型細胞因子的產生,使免疫細胞活性信號的表達上調,促進腫瘤細胞 MHC- I的表達加強免疫。
研究發現將放療敏感三陰性乳腺癌細胞加入放療不敏感小鼠腫瘤體內接受放療,發現抑制癌細胞的 M1 亞型巨噬細胞和 DC 細胞增多,促進癌細胞的 M2 型巨噬細胞減少,可提高免疫治療癌癥的療效。
體內和體外研究均顯示放療可以促進三陰性乳腺癌細胞釋放損傷相關蛋白,促進免疫細胞激活、分化和成熟,提高放療和免疫治療協同的療效。
綜上 NK 細胞作為免疫細胞的一種,與放療聯合治療乳腺癌方面可能取得良好效果。
NK 細胞過繼免疫治療及其他治療
自體與異體 NK 細胞免疫療法
自體 NK 細胞免疫療法主要原理是通過提取患者血液,在經過分離技術提取、細胞培養獲得高效識別殺滅腫瘤細胞的能力后重新注入體內,達到治療腫瘤的目的。
自體 NK 細胞療法在腎癌和黑色素瘤已經取得一定療效,而在骨髓瘤細胞和腦膠質瘤療效更顯著,但并非所有患者均可獲益;異體NK 細胞可使用非患者自身提供的 NK 細胞,不會引起排斥反應,可引發很強的免疫效應,不會引起細胞因綜合征。
一項關于復發性髓母細胞瘤和室管膜瘤的兒童用離體擴增的 NK 治療的 I 期臨床試驗,驗證了 NK 良好的安全性和治療效果。
嵌合抗原受體 NK 細胞
嵌合抗原受體 NK 細胞因缺乏克隆擴增等而表現為低效力,但可以使細胞因子風暴和腫瘤裂解綜合征發生的可能性降到最低,使得免疫治療更安全;在慢性淋巴細胞白血病和復發或難治的非霍奇金淋巴瘤病人中 I/IIa 期試驗顯示高達64% 的患者實現了完全緩解;最近三陰性乳腺癌擇性組織因子 (TF) 分子,TF-CAR NK 細胞可使TNBC 細胞系的細胞毒性增加,其治療TNBC安全有效 。
盡管有體外擴增的自體NK 細胞靜脈輸注的多項試驗和結合了 HER2 構建的 NK 細胞,但至今還沒有關于乳腺癌人體試驗的公開數據記載。
最近,一項研究通過消耗人 iPSC 衍生的 NK 細胞中的 CISH 重新編程 NK 細胞代謝,在體內獲得持久的抗腫瘤活性,這可能是一種新的改善療效方法。
總之,NK 細胞對腫瘤免疫治療表現出良好的勢頭,作為機體的免疫細胞,以其獨特的優勢在不同癌癥治療上取得良好治療效果。
隨著 NK 細胞各種臨床試驗進行,特別是 NK 細胞基因修飾及聯合治療等,可能在某種程度上解放了腫瘤對 NK 細胞的抑制,加強治療效果,未來可能在乳腺癌上取得更大的療效,進而推動 NK 細胞進行全面人體臨床試驗,使乳腺癌患者在更大程度上獲益。
說明:本文案例均摘錄于文獻,僅用于科普干細胞相關知識,不作為醫療建議。
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/18193.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃