DNA損傷反應(DDR)通路的遺傳改變是B細胞惡性腫瘤中化學免疫療法(CIT)耐藥的常見機制。之前已經表明,CIT的協同作用依賴于化療引起的腫瘤細胞和巨噬細胞之間的分泌串擾。然而,惡性細胞中DNA損傷途徑的改變如何在功能上影響CIT的復雜相互作用和結果仍有待闡明。近日,來自德國科隆大學醫院的研究人員在Blood雜志上發表文章,報道了腫瘤細胞分泌的細胞外囊泡和PDL1抑制巨噬細胞的功能,進而導致TP53缺陷型B細胞惡性腫瘤的治療抵抗。

腫瘤微環境(TME)的特點是惡性細胞與非惡性基質或免疫細胞的多重相互作用。特別是,巨噬細胞處于該網絡的中心階段,決定疾病進展、治療反應以及難治性生態位。以前的研究表明巨噬細胞發揮抗體依賴性細胞吞噬作用(ADCP),并作為在侵襲性B細胞淋巴瘤和多發性骨髓瘤的化學免疫療法(CIT)給藥中協同作用的重要介質。這種特定的聯合治療通過將腫瘤相關巨噬細胞從抑制狀態重新極化為活化表型,大大增加了腫瘤清除率。CIT是許多B細胞惡性腫瘤的標準療法,主要針對CD20,例如利妥昔單抗與氟達拉濱/環磷酰胺(R-FC)或環磷酰胺、多柔比星、長春新堿和潑尼松(R-CHOP)聯合使用。盡管CIT在一線治療中取得了成功,但復發或難治性疾病的治療,尤其是彌漫性大B細胞淋巴瘤(DLBCL)的治療仍然是一項重大的臨床挑戰。盡管生發中心B細胞樣和活化B細胞亞型之間的區別以及進一步的分子亞分類為量身定制的治療策略開辟了途徑,但可用于適應一線治療以克服原發性耐藥性淋巴瘤的分子標志物有限。免疫檢查點抑制顯示作為單一療法的反應有限,盡管據報道在DLBCL患者中帕博利珠單抗(Pembrolizumab)與R-CHOP的組合顯示出改善的無進展生存期和有限的毒性。
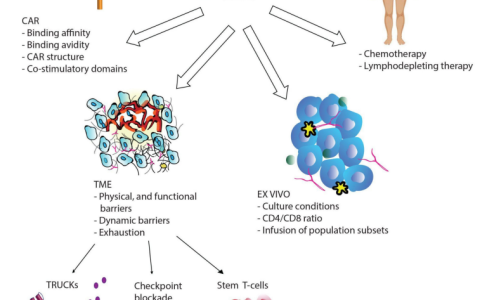
TP53突變存在于大約20%的DLBCL和10%的CLL中;因此,代表了一個重要的患者亞組。由于TP53在多種細胞應激反應中的中心協調功能,TP53的缺失或突變已被確定為多種惡性實體中化學抗性的重要介質。此外,TP53的缺失介導腫瘤微環境中的促腫瘤發生改變。惡性細胞中DNA損傷途徑的改變如何在功能上影響CIT的復雜相互作用和結果仍有待澄清。該研究主要探討了影響CIT協同效應的DDR級聯中斷。該研究數據表明,特別是TP53功能狀態通過釋放細胞外囊泡(EV)和免疫檢查點PD-L1的表達決定了TME中的細胞串擾、吞噬功能和巨噬細胞依賴性治療反應。

EV和PD-L1表達對TP53缺陷B細胞淋巴瘤化療耐藥的作用
該研究表明DDR通路的多個不同成員的喪失在體外和體內抑制了巨噬細胞的吞噬能力。特別是TP53的缺失導致多種B細胞惡性腫瘤的離體吞噬能力降低。該研究使用Eμ-TCL1小鼠模型通過體內環磷酰胺治療證明,在Tp53缺失的白血病中巨噬細胞吞噬能力的喪失是由使用scRNA-Seq的吞噬轉錄組特征的顯著下調驅動的。通過分析腫瘤B細胞蛋白質組,該研究確定了與細胞外囊泡(EV)相關的蛋白質的TP53特異性上調。通過RAB27A的CRISPR敲除(KO)消除了腫瘤B細胞中的EV生物發生,并證實來自TP53缺失的淋巴瘤細胞的EV是導致吞噬能力降低和體內CIT抗性的原因。此外,TP53缺失導致淋巴瘤細胞PD-L1細胞表面表達和EV分泌上調。抗PD-L1抗體或PD-L1 CRISPR-KO破壞EV結合的PD-L1提高了巨噬細胞吞噬能力和體內治療反應。因此,該研究證明TP53缺陷型B細胞淋巴瘤中EV釋放增強和PD-L1表達增加是CIT抗性中巨噬細胞功能改變的新機制。該研究表明檢查點抑制在B細胞惡性腫瘤與TP53缺失的聯合治療中的應用。
要點:
-
TP53的缺失增加了B細胞淋巴瘤細胞的PDL1表達和細胞外囊泡(EV)的形成;
-
靶向PDL1并抑制EV釋放克服了TP53介導的化學免疫療法(CIT)耐藥性。
參考文獻:
IzquierdoE, et al. Extracellular vesicles and PDL1 suppress macrophages inducingtherapy resistance in TP53-deficient B-cell malignancies. Blood.2022 Mar 28:blood.2021014007. doi: 10.1182/blood.2021014007. Epub ahead ofprint. PMID: 35344582.
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/11907.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃