為了促進干細胞臨床轉化,我國干細胞臨床研究采用“類雙軌制”管理。一是,在國家衛生健康委員會和國家藥品監督管理局(簡稱兩委局)聯合管理的秘書處申請機構和項目的雙備案;二是,在國家藥品監督管理局(NMPA)申請藥品注冊臨床試驗。
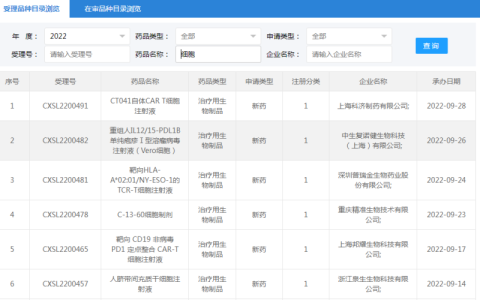
目前通過機構備案的一百多家醫院,有近百個項目。申請藥品注冊的臨床試驗干細胞項目有47項(注:小編新更新數據,截止2022年8月31數據)。突出的問題是備案項目在研究和開展中進展緩慢,項目執行不盡人意,存在眾多問題和瓶頸需要克服。本人作為“兩委局”和醫院參與干細胞項目相關工作的專家有些體會和思考,不當之處請大家批評指正。
–01–
雙軌制在執行過程中的異同點
無論在哪條軌道上申報,國家對干細胞制劑本身的要求都非常嚴格,明確規定干細胞制劑要符合《干細胞制劑質量控制及臨床前研究指導原則》;具體項目的實施都是在具有臨床研究資質的醫院和科室進行;項目負責人和研究團隊要有較強的專業背景和開展臨床試驗的能力。
兩委備案項目與申請國家藥品監督管理局藥品注冊臨床試驗的不同點在于主體責任和人員投入方面懸殊較大。申請藥品注冊的臨床試驗主體責任是廠家,最終受益者也是廠家。因此,廠家的目的是做出能夠獲得陽性結果臨床試驗,投入很大,一般都是在國內有影響力的醫院和學科選擇業內頂級專家牽頭國際及國內多中心臨床藥物試驗團隊,按臨床藥物試驗要求配備陣容強大有GCP資質的專業人員,廠家需要花費重金聘請專業團隊設計和協助臨床試驗,包括CRO、CRA、CRC。整個執行過程在醫院藥物臨床試驗機構和倫理委員會的嚴格監管下按照計劃進行研究。
自2015年起, 國家衛健委與國家藥品監督管理局聯合對干細胞臨床研究機構和項目雙備案,并進行動態管理。開展臨床研究以醫療機構為主體,具體項目的獨立負責人(PI)承擔著項目的組織和實施,合作的公司或廠家主要負責制劑的制備、部分經費和人員的投入。臨床研究主要選擇的適應證是目前沒有更好治療方法的疾病或罕見病等,多為探索性研究。項目負責人的執行力在臨床研究的執行中有很大的作用,這也是不能與申請藥品注冊的臨床試驗相比的主要原因。
–02–
干細胞被公認為是人類醫藥發展史上最為復雜的醫藥品。干細胞的科學性、應用的廣泛性、制備工藝的多樣性和相關風險因素,導致其在質量特性上表現出多樣性、復雜性、異質性和變異性,
干細胞是活的細胞,廠家生產除了考慮其生物學特征以外,要有一系列的質量控制要求,包括細胞活率、病原微生物檢測等。對干細胞的儲存運輸環境有嚴格的冷鏈要求,且在應用前應檢測并留樣。
干細胞臨床研究項目備案后,醫院承擔主體責任。合作廠家或公司的資金投入大多集中于細胞制劑研發,在臨床試驗過程中的投入有限,而醫院由于沒有這方面的專項經費支持,往往存在后期費用不足。
為了支持干細胞臨床研究,科技部和地方政府投入大量資金用于干細胞臨床研究,獲批的項目需要按照兩委項目備案的要求,尤其要進行多中心臨床研究。由于資料準備往往不充分,多數不符合備案要求,申報周期長,資金使用受限制,造成項目執行困難。
干細胞臨床研究選擇的適應證,通常是常規治療效果不佳的疑難疾病和罕見病。從目前的臨床研究結果來看,干細胞的安全性較好,但療效難以評判,多數臨床研究需要擴大樣本量。無法準確估計樣本量,給受試者入組帶來不便,且某些罕見病本身就存在入組困難的問題。
–03–
為了使干細胞臨床研究有序開展,我國相繼制定多個指導原則和管理辦法,要求干細胞臨床研究機構強化學術委員會和倫理委員會的獨立審查制度。
但是,在醫院中進行干細胞臨床研究的負責人和管理人員對主要科學問題和倫理問題認知度不同,醫院的科學性評價和倫理管理水平也參差不齊,主要表現在以下幾個方面:
干細胞治療是新興的治療方法,針對不同疾病的特點,干細胞臨床研究方案需滿足科學性、可行性和倫理合規性三方面要求,需要臨床試驗設計專家、制劑專家、相關疾病領域專家和課題負責人等組織團隊一起共同完成臨床試驗設計。目前,備案項目PI的背景參差不齊,對干細胞臨床試驗的理解不同,雖然主持過國內及國際多中心臨床研究,對于臨床問題的研究是強項。但是,因為干細胞的特殊治療作用對樣本量的估計可能不足,備案項目PI對干細胞和制劑的選擇方面認識也不統一。
機構工作人員,既往沒有接觸過細胞藥物,相關部門也沒有接受過系統培訓。目前,已經通過國家藥品管理局默許開展干細胞臨床試驗的干細胞制劑有14種,而大多數機構工作人員對干細胞認識不足。
通過機構備案項目的管理一般在科研管理部門。而細胞治療項目不同于臨床科研項目,不能按常規項目進行管理。需要科研管理部門和臨床試驗/研究機構,無縫對接共同管理。
干細胞學術委員會和倫理委員會委員,需要不斷學習提高干細胞臨床試驗相關知識,更新知識結構,熟悉干細胞制劑、治療機理、法律法規、風險評估、特殊的倫理問題等。
–04–
我國早在“十五”計劃開始,就緊跟國際前沿著手布局干細胞研究,“十三五”期間主要投入干細胞的臨床轉化,整體提升了我國在干細胞及其轉化應用領域的核心競爭力,加快了科研成果的應用。在“類雙軌制”下,臨床研究備案項目100個,藥品注冊臨床試驗受理的項目34個(注:小編新更新數據,截止時間2022年8月31日)。在執行過程中,上述諸多問題限制了干細胞臨床試驗和研究。建議如下:
▉?全面提高干細胞臨床試驗研究能力
雖然兩委局針對干細胞備案項目相關管理者、質量授權人、項目負責人等進行了多次培訓,但遠遠達不到目前臨床試驗的需求。干細胞臨床試驗對于所有的管理者和研究者來說都是新生事物,并有其特殊性,需要共同學習提高,不斷總結經驗。因此,建議對雙軌制中,所有臨床試驗和臨床研究加大培訓力度,提高項目成員及評審專家的專業能力。
▉?應當加大干細胞臨床試驗投入
無論是申請國家藥品監督管理局(NMPA)藥品注冊臨床試驗,還是申請兩委局備案項目,負責細胞制備的公司或廠家均須以藥品注冊臨床試驗的標準投入人力、物力和財力,聘請和配備具有CRO、CRA、CRC能力的人員協助臨床試驗。
具備干細胞研究能力的醫院,需全方位提高干細胞管理和研究能力。醫院是干細胞制劑和臨床研究質量管理的責任主體,而干細胞制劑很少在醫院自己開展制備,因此對制劑制備者的選擇非常重要,單靠干細胞制劑質量授權人難以嚴格把關。建議,醫院的干細胞學術委員會委員和倫理委員會委員中要有多名具備醫學專業背景和具備細胞制劑、質量管理經驗的成員,必要時可請相關領域的獨立顧問對項目進行審查。
在兩委局備案的項目中,有醫院及內部管理部門、公司或者廠家、項目負責人等。建議,明確各自的責權利,推進干細胞臨床研究。人員配備類似藥品注冊臨床試驗的隊伍,不能降低質量。
十三五期間,科技部和地方政府投入了大量的科研經費,用于干細胞臨床研究,希望通過資金支持促進干細胞臨床研究,但在執行過程中多個項目由于不符合兩委局備案要求,難以開展,而已經開展的項目由于經費使用的規定也難以進行。需要科技部和兩委局積極溝通,密切合作推動干細胞臨床研究。
總之,我國政府高度重視干細胞的臨床研究和應用,通過多種舉措推進干細胞臨床試驗,希望能夠通過干細胞技術治療難治性疾病。相信未來,隨著干細胞技術的突飛猛進以,也隨著我們對干細胞臨床試驗認識的不斷提高,必將克服重重困難,讓干細胞技術造福人類。
本文來源于《醫學參考報》干細胞與再生醫學頻道(ID :yxckbsc2021050201)
現任北京大學人民醫院婦科腫瘤研究室副主任,博士生導師。為中國女醫師協會干細胞與免疫細胞專業委員會主任委員、中國整形美容協會干細胞研究與應用分會第一屆理事會常務理事、中國醫藥生物技術協會理事、中關村標準化協會智庫專家、中關村細胞治療標準分技術委員會副主任委員、中國女醫師協會婦產科專業委員會委員,《中國婦產科臨床雜志》編委、《中國醫藥生物技術雜志》編委、《中國計劃生育和婦產科》編委。主持多項國家級和省部級基金項目,在國內外學術期刊發表論文100余篇,參加編輯婦產科及臨床腫瘤學專著3部。?
編輯:小果果,轉載請注明出處:http://www.448371.com/zixun/hydt/16482.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。





 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃