原標題Extracellular vesicle-based therapeutics: natural versus engineered targeting and trafficking,作者Daniel E. Murphy, Olivier G. de Jong等來自
荷蘭烏得勒支UMC臨床化學和血液學實驗室,該文此前發表在Experimental & Molecular Medicine。
細胞外囊泡 (EV) 越來越多地被認為是通過傳遞效應分子來傳遞細胞間信號的介質。有趣的是,某些類型的細胞外囊泡?也能夠誘導治療反應。
由于這些原因,細胞外囊泡的治療潛力是一個深入研究的主題,無論是在藥物輸送還是再生醫學的背景下。然而,為了充分利用細胞外囊泡用于治療目的,更好地理解它們的作用機制將是非常有利的。
在這里,作者回顧了有關 EV 細胞攝取和運輸的當前知識狀態,并考慮了這些途徑如何潛在地影響治療性 細胞外囊泡?的功能。此外,還討論了外源性細胞外囊泡?的天然細胞靶向能力、生物分布特征和藥代動力學,以及負責這些特征的組件。還提供了潛在臨床應用的概述和成功使用的臨床前示例。最后,已成功用于改善其治療特性的細胞外囊泡修飾示例受到特別關注。作者建議,除了研究 EV 細胞靶向和攝取途徑外,還需要對受體細胞的細胞內運輸途徑進行未來研究,以最佳地利用細胞外囊泡進行治療。
生物制品開發和應用的一個主要限制因素是將這些分子遞送至其作用位點的適當方法。例如,RNA 療法因其改變基因表達的能力而具有巨大的潛力。然而,大的極性 RNA 分子無法穿過細胞膜,并且會被細胞外 RNases 快速消化。
目前旨在克服這些障礙的常規策略包括將治療性 RNA 包裹在合成納米顆粒中1 或將 RNA 與旨在促進攝取的特定配體結合。FDA 批準的Alnylam 開發的脂質納米顆粒 (LNP),用于遞送 siRNA 以治療遺傳性轉甲狀腺素蛋白淀粉樣變性,這是有史以來第一個獲批的基于 RNA 干擾的藥物。LNPs 保護其脆弱的貨物免于降解并促進進入細胞。盡管克服了這些障礙,LNP 仍可表現出(劑量限制)毒性,并且 LNP 介導的 RNA 傳遞在很大程度上僅限于肝臟。因此,向其他組織的無效遞送繼續延遲有效治療策略的發展。
迫切需要解決這一藥物輸送問題,因此,細胞外囊泡 (EVs) 的治療潛力已成為研究熱點。這些直徑為 30-1000nm 的脂質結合顆粒在它們從供體細胞釋放并隨后內化到周圍或遠處的受體細胞后促進細胞間通訊。
這一過程導致其蛋白質、脂質和 RNA 貨物的轉移,從而在受體細胞中引發反應。由于這種作為內源性細胞間貨物轉運系統的能力,細胞外囊泡被研究用作藥物輸送的潛在載體。除了提供外源性治療貨物的能力外,某些 EV 還具有固有的治療特性,尤其是在再生醫學的背景下。
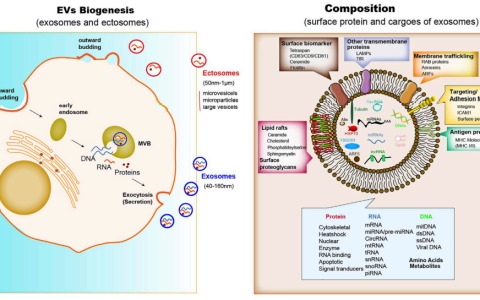
為了了解 EV 如何以最佳方式用于治療目的,重要的是了解它們的形成過程以及它們在健康和疾病中的作用。EV 根據其生物發生分為兩種主要亞型——外泌體和微泡。
外泌體的直徑范圍為 30-100nm,來源于內體區室。相反,微泡是通過從細胞膜出芽和夾斷的過程形成的。它們的大小高度異質,直徑從 50 到 1000 納米不等。
外泌體通過向內出芽的過程在多泡內體 (MVE) 內形成,導致腔內囊泡 (ILV) 的形成。這些 ILV 在 MVE 成熟并隨后與細胞表面融合后被釋放到細胞外環境中——此時它們被稱為外泌體。
這個過程取決于許多途徑,其中許多尚未完全闡明;然而,在此過程中起重要作用的蛋白質是轉運 (ESCRT) 蛋白質家族所需的內體分選復合物。ESCRT 家族的各種成員負責 MVE 膜上蛋白質的組織,并最終在 ESCRT-III9 的協助下萌芽到 MVE 腔中。
ILV 也通過不需要 ESCRT 復合體的過程生成。ESCRT 獨立 ILV 形成所需的一個重要因素是四跨膜蛋白 CD63。CD63 是一種典型的 EV 蛋白標志物,其在 EV 生物發生中的重要性通過觀察其敲除導致人胚胎腎 293 (HEK293) 細胞釋放 EV 減少而突出顯示。
不依賴 ESCRT 的 ILV 形成的另一個重要介質是中性鞘磷脂酶。這種酶負責合成脂質神經酰胺,在 MVE 膜上形成微區,這一過程對 ILV 的產生至關重要。這些富含神經酰胺的脂質微區的形成之后是向內的內陷,這可能由神經酰胺分子的錐形形狀促進。
最近已顯示其他蛋白質參與外泌體形成。Hsp90 是一種伴侶蛋白,似乎表現出特定的 MVE 相關活性,可觸發 MVE 的變形、MVE 與質膜的融合以及隨后外泌體的釋放。需要進一步的研究來闡明微泡形成是否是一個完全不依賴于 Hsp90 的過程。
與外泌體類似,微泡的分泌也部分依賴于 ESCRT,并且需要在質膜上形成脂質微區。據報道,ESCRT-1 組分腫瘤易感基因 101 在細胞表面與含有抑制蛋白結構域的蛋白 1 相互作用,介導微泡的出芽。
此外,富含神經酰胺的脂質微區的形成也參與了微泡的形成。與外泌體形成相反,其中 ESCRT-III 負責將 ILVs 分裂到 MVE 腔中,由 ADP-核糖基化因子 6 介導的肌動蛋白-肌球蛋白細胞骨架網絡的重組是出芽微泡從細胞釋放的機制。
EV 裝載了多種蛋白質,其中一些蛋白質對于大多數細胞類型釋放的大多數 EV 子集都是常見的,例如膜結合的四跨膜蛋白 CD9、CD81 和 CD6318。在僅源自特定細胞類型亞群的 EV 中檢測到其他的,例如被稱為 EGFRvIII 的截短形式的表皮生長因子受體,它已在神經膠質瘤衍生的 EV 的表面上發現。
除了蛋白質含量外,EV 還裝載有核酸。例如,有些 EV 中加載的 mRNA 轉錄本可以在功能上從生產者轉移到受體細胞。非編碼 RNA (ncRNA),如 microRNA (miRNA) 也裝載在 EV 中,其中一些與它們的起源細胞相比富集。
ncRNA 的摻入也受生產細胞狀態的影響。例如,免疫激活已被證明會影響樹突狀細胞衍生的 EVs 的 ncRNA 轉錄組。這些觀察結果表明,EVs 的 ncRNA 含量起著生理作用。此外,在 EVs中也發現了各種類型的 DNA,例如線粒體和基因組 DNA。
EV 的脂質成分與細胞膜的成分明顯不同。EV 可富含磷脂酰絲氨酸 (PS)、正向調節外膜曲率的脂質,如溶血磷脂酰膽堿和負向調節內膜曲率的脂質,如心磷脂。EV 中所含的脂質可能發揮信號傳導功能。例如,EV 中存在的類花生酸,如前列腺素和白三烯,與信號傳導過程有關。
在大多數情況下,細胞外囊泡發揮其功能的確切機制仍有待闡明。然而,一些細胞外囊泡會轉移活性貨物,這些貨物已被明確證明會在受體細胞中引起反應。EVs 將趨化因子受體 5 (CCR5) 從 CCR5+ 細胞功能轉移到 CCR5- 單核細胞提供了 HIV 感染所需的重要因素,并使先前的抗性細胞對感染敏感。
EGFRvIII 顯示通過 EV 從 EGFRvIII 陽性膠質瘤細胞轉移到 EGFRvIII 陰性膠質瘤細胞。有趣的是,這種轉移導致受體細胞中 EGFRvIII 介導的致癌途徑的激活。
除了功能性蛋白質轉移外,EV 介導的 RNA 傳遞也與病理生理過程有關。例如,已證明 miRNA-19 通過 EV 從星形膠質細胞轉移到乳腺癌細胞可抑制其靶標 PTEN 的表達。PTEN 表達的這種降低與體內轉移性生長的腫瘤微環境的啟動有關。
此外,EV 介導的 RNA 轉移也被證明可以促進體內轉移表型的誘導。將含有 mRNA 轉錄物的 EV 從高度轉移性的 MDA-MB-231 細胞轉移到轉移性較低的 T47D 細胞,在功能上吸收 MDA-MB-231 衍生的 EVs 的細胞中誘導了高度轉移性表型。
EVs 已被證明可以通過 RNA 和蛋白質分子的傳遞來誘導功能效應,這一事實為 EV 治療領域提供了巨大的希望。為了誘導它們的功能影響,這些 EV 傳遞的分子必須以足夠的數量到達它們在細胞內的作用部位。
引人注目的是,尚未確定負責 EV 介導的這些分子傳遞的機制。盡管有一些證據表明特定 EV 類型能夠通過與質膜直接融合來運送貨物,但 EV 最有可能通過類似于病毒的途徑通過內體隔室逃逸來運送貨物。預計通過闡明 EV 貨物遞送過程,藥物遞送領域可能能夠改善治療分子向其細胞內作用位點的遞送。
細胞外囊泡(EVs)療法
EVs 具有固有的促進組織修復的特性,可以在治療上加以利用。例如,研究人員最初認為間充質干細胞 (MSC) 的心臟保護特性是由于它們分化為健康的心肌。然而,后來證明這種影響是由于 MSCs 對周圍宿主組織的旁分泌作用。當證明 EV 是 MSC 介導的心臟保護的重要組成部分時,人們對 EV 的治療潛力產生了極大的興趣。自從這一發現以來,廣泛的臨床前研究揭示了 EV 在肝臟和心臟再生醫學中作為治療劑的效用。
在再生醫學的背景下,與基于細胞的療法相比,EV 具有許多優勢。一個主要優勢是,取決于其來源,EV 的免疫原性可能低于其親代細胞,這可能是由于其表面上的 MHC 復合物等跨膜蛋白豐度較低。與活細胞不同,細胞外囊泡的保質期很長,可以長期運輸和儲存。此外,細胞外囊泡在注射后不會復制。因此,EV 產生腫瘤和轉移潛伏病毒病原體的風險較小。
細胞外囊泡還具有許多作為藥物輸送載體的優勢特性,可以幫助它們超越合成藥物載體。值得注意的是,細胞外囊泡似乎具有穿越組織和細胞屏障的內在能力。
此外,合成藥物載體,如 LNP 和聚合物膠束,具有高免疫原性和毒性。由于治療性 EV 來源于自體或良性生物來源,它們不太可能誘發這些不良反應。事實上,MSC 衍生的 EV 已被證明對免疫反應產生抑制作用。
此外,一些 EV 可能具有固有的靶向特性,并顯示出對特定細胞或組織的趨向性。可以利用此功能選擇性地將藥物輸送到其預期目標,同時避免脫靶效應。
細胞外囊泡已成功用作臨床前環境中的藥物輸送系統。最近,通過電穿孔產生了大量裝載抗 KRASG12D siRNA 的 MSC 衍生的 EV,它們能夠提高胰腺癌小鼠模型的存活率。然而,應該指出的是,關于電穿孔將 siRNA 加載到 EVs的有效性存在爭議。細胞外囊泡也已成功用于臨床前再生醫學。例如,MSC 衍生的 EV 能夠在關節內注射后在大鼠關節損傷模型中誘導骨軟骨再生。
許多額外的例子揭示了細胞外囊泡在臨床前的成功應用,其中一些在本綜述的后面部分進行了總結。然而,為了充分利用 EV 的這些特征用于治療目的,需要更好地了解其固有的一般特征,例如 EV 循環動力學、靶向、內化和細胞內運輸路線,而不是關注這些具體示例。
在這篇綜述中,作者旨在總結關于這些主題的當前知識。作者還旨在總結改變 EV 特性以提高其治療活性的方法(圖 1)。
圖 1:細胞外囊泡的自然發生或人為特征會改變流通時間和目標。

| 添加聚乙二醇 (1) 增加了循環時間 79,CD4747 (2) 的存在抑制了巨噬細胞從循環中的攝取和清除,而 PS58 (3) 被巨噬細胞識別,導致清除增加。EV 的整合素 (4)、脂質 (5) 和四跨膜蛋白 (6) 組合物影響其天然靶向特性。通過添加通過乳粘蛋白的磷脂酰絲氨酸結合 C1C2 結構域錨定的靶向部分改變這些靶向特性 82 (7)、溶酶體相關膜蛋白 2 融合蛋白的表達 38 (8)、糖基磷脂酰肌醇錨定的靶向部分 81 (9) 和轉鐵蛋白共軛磁性顆粒與 EVs93 上表達的轉鐵蛋白受體結合 (10)
細胞外囊泡的循環動力學和生物分布
EV 的表面蛋白成分部分負責確定其循環動力學和生物分布曲線。觀察結果清楚地證明了這一點,即在通過靜脈注射給藥之前對 EV 進行蛋白酶處理會導致 EV 的清除延遲。蛋白酶處理還顯著減少了 EV 在肺部的積累,但并未改變巨噬細胞的攝取。然而,根據其他研究,EV 表面蛋白確實會影響巨噬細胞的攝取。例如,已發現 CD47 可抑制巨噬細胞對 EV 的攝取。
治療性 EV 的生物分布是其有效性和安全性的一個關鍵方面。為了成功地利用 EV 進行治療,更好地理解外源性 EV 的生物分布特征至關重要。使用用親脂性染料標記的 EV,發現 EV 主要在小鼠的肝臟、脾臟和胃腸道中積累,但生物分布可能會受到給藥途徑的影響。
有趣的是,EV 的細胞來源也影響了這一特征,這表明來自不同細胞來源的 EV 具有不同的靶向特性。來自 HEK293T 細胞的 EV 也積聚在皮下腫瘤中,這一特性可以被基于 EV 的抗癌療法所利用。
為生物分布研究標記 EV 的另一種方法是用熒光素酶標記 EV。使用這種方法,發現熒光素酶標記的 EV 主要在肺、肝、脾和腎中積累。此外,從各種小鼠細胞系中提取的帶有 Gaussiaprinceps 熒光素酶標記的 EV 被用來證明靜脈內給藥的 EV 在肝臟中積累,并以部分巨噬細胞依賴性的方式迅速從循環中清除。盡管在使用不同來源的 EV 和不同標記技術的研究之間觀察到生物分布存在差異,但普遍的共識是,大部分 EV 注定會在肝臟和脾臟中積聚,可用于特定的治療靶向這些器官中。
除了細胞源的影響外,不同尺寸的細胞外囊泡也被證明具有不同的生物分布特征。非對稱流場分餾已被用于根據大小分離 EV 的三個子集。這些子集具有不同的分子組成和生物物理特性。與其他觀察結果一致,所有亞群中的大多數都在肝臟中積累。然而,與較小的子集相比,大型 EV 在骨骼和淋巴結中的積累水平顯著更高。這是一個有趣的觀察結果,但尚不清楚這是否是 EV 大小本身的結果,而不是它們不同分子組成的結果。
這些研究都沒有發現 EV 在大腦中的顯著分布。然而,有一些證據表明這可能會在缺血性中風的情況下發生變化。在小鼠模型中,在中風半影區觀察到心臟球衍生的 EV 的強烈攝取。這種現象可用于治療中風后受損組織的靶向治療。
盡管這些研究提供了知識,但對影響生物分布的因素的更好理解對于改進有針對性的 EV 交付將非常有益。
靶向和內化——細胞外囊泡的自然靶向特性
EV 要發揮其功能,必須首先與其受體細胞結合,而且眾所周知,不同的 EV 能夠優先結合特定的靶細胞類型。EV 的這種固有靶向能力是一種可用于將 EV 藥物輸送工具靶向其所需作用部位的功能。表 1 總結了一些已知會影響 EV 定位的功能。
表 1 影響目標的自然 EV 特征概述

如上所述,細胞外囊泡的蛋白質含量會改變靶向行為。例如,與亞基 β1 和 β4 復合的整合素 α6 的 EV 被定向到肺中的 S100-A4 陽性成纖維細胞和表面活性蛋白 C 陽性上皮細胞。表達亞基 β5 和 β4 的 EV 分別優先靶向肝臟中的 Kupffer 細胞和大腦中的 CD31 陽性內皮細胞。
tetraspanin 類蛋白質在許多 EV 類型的表面上含量豐富,并且已經研究了它們在 EV 靶向中的作用。這類蛋白質與其他四跨膜蛋白和整合素形成多種復合物,并且這些復合物已被證明可以確定靶向行為。
例如,已顯示四跨膜蛋白 Tspan8 與整合素 α4 的復合物可選擇性地將 EV 靶向胰腺中的細胞54。此外,CD63 陽性 EV 已被證明靶向神經元和神經膠質細胞,而 CD63 陰性 EV 僅與神經元的樹突結合。另外,存在于 EV 表面的纖連蛋白與通過與硫酸肝素蛋白多糖的相互作用將微血管內皮細胞衍生的 EV 靶向少突膠質細胞前體細胞有關。
EV 脂質成分也會影響靶向行為,最明顯的例子是通過識別 EV 表面的 PS 來靶向巨噬細胞。PS 在這種相互作用中的重要性通過以下觀察得到證實:PS 包被的珠子通過 T 細胞免疫球蛋白粘蛋白 4 受體的束縛被吞噬細胞靶向并吸收。
此外,已顯示含有 PS 的脂質體通過與巨噬細胞競爭并抑制其被巨噬細胞攝取來減少 EV 的攝取。巨噬細胞對 PS 的這種識別可能部分由其負電荷介導,因為帶負電荷的含有磷脂酰甘油的脂質體的攝取也抑制了攝取,而含有中性磷脂酰膽堿的脂質體則沒有。
除了 EV 靶向的脂質和蛋白質決定因素外,EV 表面的聚糖也在細胞靶向或攝取中發揮作用。已顯示聚糖通過與 CCR8 配體 CCL1859 的三重相互作用將 EV 靶向 CCR8 陽性膠質母細胞瘤細胞,而 MSC 衍生的 EV 上的聚糖已顯示將 EV 導向表面結合的唾液酸結合免疫球蛋白,例如凝集素受體,在 HeLa 細胞表面表達 60。
目標化和內化——細胞外囊泡內化的機制
研究 EV 內部化的方式很重要,因為這可能對功能結果至關重要,因為 EV 內部化的途徑決定了貨物交付的功能響應或效率。
EVs 可以通過多種途徑被受體細胞內化,包括吞噬作用、巨胞飲作用和受體介導的內吞作用。這些途徑導致形成含有內化物質的細胞內囊泡,然后可以進一步加工或分類以進行降解。
細胞外囊泡也可以直接與細胞膜融合;然而,這一過程的例子很少被報道。已經對 EV 的攝取途徑進行了廣泛的研究,其中一些總結在表 2 中。許多攝取途徑與 EV 功能有關,主要的攝取途徑似乎取決于所研究的細胞類型。
表 2 細胞外囊泡吸收途徑研究概況
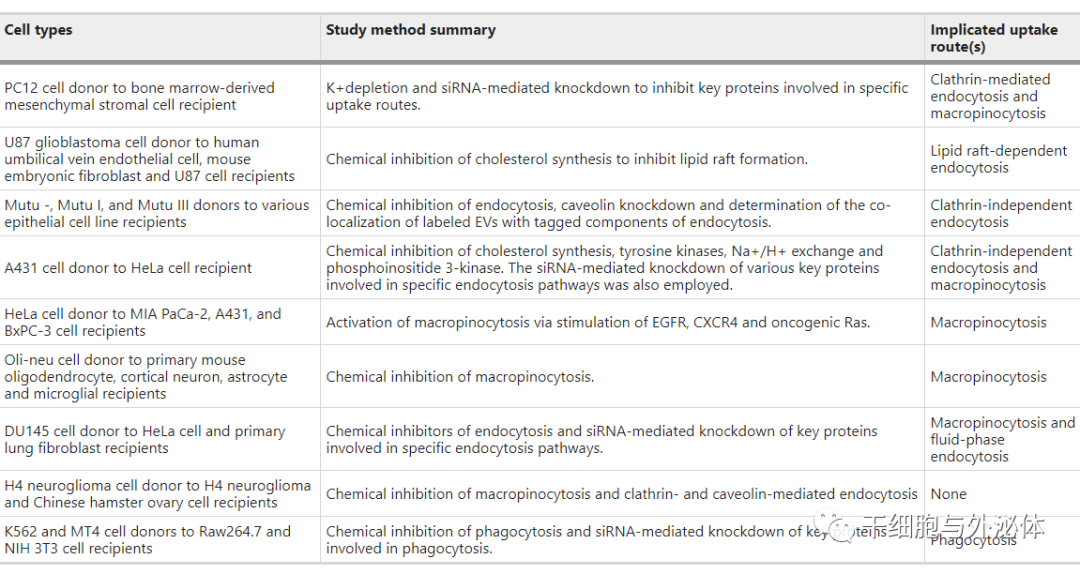
網格蛋白介導的內吞作用是一種廣為人知的細胞外物質攝取途徑,涉及網格蛋白包被的內吞囊泡的形成。CME 與 EV 的攝取有關,因為它的抑制導致骨髓來源的間充質基質細胞的攝取減少 。
不依賴網格蛋白的內吞作用,包括在細胞膜上形成小窩蛋白涂層內陷61,是 EV 攝取的另一種途徑。應該指出的是,這種依賴于小窩蛋白的內吞作用也被確定為 EV 攝取的負調節劑。
此外,EV 攝取的主要途徑是巨胞飲作用。這涉及在依賴于肌動蛋白聚合的過程中將大量細胞外液吸收到大核糖體中。已經報道了許多通過這種途徑攝取 EV 的例子。最后,巨噬細胞等吞噬細胞也通過吞噬作用吸收 EV。
脂蛋白的攝取通常與特定受體的存在有關。例如,現在已經很好地表征了 LDL 的攝取,并且早就發現了一種受體。目前,研究人員尚未確定這種真正的受體是否存在于一般的 EV 中,或者至少存在于特定的 EV 亞型中。所有上述蛋白質都廣泛參與 EV 靶向和攝取,但對于 EV 攝取來說既不充分也不是絕對必需的。發現特定類型或亞型 EV 的假定攝取受體將極大地改進工程 EV 療法的設計。
EV 的吸收途徑多種多樣,取決于生產者和受體細胞類型。為了成功開發治療性 EV,確定哪些攝取途徑會導致高水平的功能性貨物輸送,從而使治療性 EV 可以轉向這條路線,這將是非常有趣的。
細胞外囊泡的細胞內運輸攝取后,細胞外物質與胞質溶膠保持分離,并在早期內體 (EE) 中進入內體系統。大多數 EE 內容注定要在溶酶體的酸性環境中降解,包括內化的 EVs。
然而,要讓細胞外囊泡發揮其功能,它們的貨物必須到達其細胞內的作用部位。EV 至少部分避免這種降解途徑的能力通過觀察到 EV 在成熟樹突狀細胞攝取后遵循與人類免疫缺陷病毒相似的傳播途徑進行傳播。
這一觀察結果非常有趣,因為它表明 EV 能夠繞過降解攝取途徑,但這一發現可能是樹突狀細胞特有的。還應該指出的是,蛋白酶處理并沒有改變這種攝取后的販運,這表明這種觀察可能不是 EV 特異性特征的結果。盡管存在這些擔憂,但可能存在一種 EV 在攝取后從降解途徑中逃逸的機制,因為在許多情況下已經觀察到 EV 能夠通過運送貨物來發揮功能效應。
為了研究降解逃逸的可能途徑,生產了用 CD63-GFP/CD63-mCherry 標記的 EV,并在人類原代成纖維細胞、Huh7 和 HEK293 細胞內化后進行跟蹤。攝取后,可見 EV 被較大的囊泡包圍,然后這些囊泡被運送到 ER 細絲,在那里觀察到與 ER 的相互作用,如顯微鏡所示。建議在囊泡和 ER 之間的這些相互作用位點進行潛在的內容交換。
已知 Rab5 和 Rab7 陽性內體囊泡與 ER74 相互作用這一事實加強了這一假設。這種潛在的功能性內容釋放過程(需要內容物穿過外泌體和內體膜)的機制仍然未知。關于 miRNA 和 siRNA,如果 EV 介導的向 ER 的傳遞是可能的,這可能是功能性改變基因表達的途徑。
通過 PC12 細胞中的活細胞熒光顯微鏡對用親脂性染料和氨基反應性熒光團標記的內化 PC12 細胞衍生的 EV 進行分析,發現 EV 首先被封裝在 EE 中,然后向核周空間移動,也就是核內體的位置作為溶酶體。
在這里,觀察到標記的蛋白質信號在 3 小時內開始與 EV 膜信號分離,表明 EV 膜中的跨膜蛋白和脂質分離。在 6 到 24 小時之間,脂質標記的 EV 的信號顯著降低,并且不存在于核周空間中,這表明脂質被回收并運輸到細胞的其他部分。相反,跨膜蛋白的信號仍然可以在核周空間中觀察到,這表明大部分蛋白質保留在溶酶體中。這意味著大量膜結合的 EV 貨物在攝取后在溶酶體中降解。
應該指出的是,最近發現用于 EV 標記的常用親脂性染料(例如 PKH26)形成難以與標記的 EV 區分開來并與它們共定位的顆粒,這阻礙了對 EV 販運后攝取途徑的研究。此外,EV 通常使用熒光標記的四跨膜蛋白進行跟蹤,即使發生 EV 內容傳遞,它們仍與膜相關聯。似乎很明顯,對 EV 內容釋放的評估必須涉及使用胞質 EV 標記和開發新的檢測方法來研究 EV 貨物轉移。
表明 EV 能夠在攝取后逃避內體降解途徑的證據引起了人們的極大興趣,因為該特征可用于治療遞送。然而,目前對細胞外囊泡能夠避免退化的機制知之甚少。為了充分利用 EV 作為治療劑,有必要確定其貨物運送的細胞內途徑和機制。
影響循環動力學和生物分布的工程方法
總之,與合成遞送系統相比,細胞外囊泡在其內在的治療特性和遞送功能性貨物的能力方面顯然具有許多潛在的優勢特征。然而,未經修飾的細胞外囊泡在目標組織和細胞中的清除速度快,積累量低。因此,對細胞外囊泡進行了修改,以引導其向目標行動地點交付。
為了增加循環時間并改善向目標組織的遞送,EV 已涂有聚乙二醇 (PEG),并用抗 EGFR 納米抗體進行了功能化。PEG 是一種親水性聚合物,已知會增加納米顆粒的循環時間。
發現聚乙二醇化增加了 EV 循環時間并減少了與細胞的非特異性相互作用,同時增強了納米抗體介導的與表達 EGFR 的細胞的相互作用。類似地,EV 表面通過與 1,2-雙(二甲基膦基)乙烷脂質的連接而與 PEG 綴合的鏈霉親和素遮蓋的效果也已被采用。鏈霉親和素成分促進了靶向成分的結合,成功地改變了 EV 在小鼠中的生物分布。然而,應該注意的是,已知在脂質體表面添加 PEG 會阻礙它們在攝取后從內體逃逸,這也可能適用于 PEG 化的 EVs。
另一種用于增加循環時間的方法是通過增加 EV 表面上 CD47 的表達。這種蛋白質已被證明與 PS 相反,后者促進吞噬作用的啟動和隨后被巨噬細胞從循環中清除。CD47 蛋白已在特定細胞類型的 EV 上發現,并已被證明可增加腹腔注射后的循環時間。這一特性可用于延長治療性 EV 的循環時間,從而增加靶向遞送至特定組織的窗口。
影響細胞外囊泡定位或內部化的工程方法
阻礙在治療環境中使用 EV 的一個主要挑戰是難以確保將其遞送到其治療作用部位,同時避免在脫靶部位積累。非特異性遞送會降低療效并可能導致脫靶效應。
細胞外囊泡的靶向特性可能受到生產細胞基因改造的影響。以這種方式靶向 EV 的第一個例子涉及溶酶體相關膜蛋白 2 (Lamp2b) 與狂犬病病毒糖蛋白肽的融合。Lamp2b 在 EV 表面上含量豐富,而狂犬病毒糖蛋白肽與乙酰膽堿受體特異性結合。發現這種融合蛋白賦予 EV 在全身注射后靶向大腦內神經元、少突膠質細胞和小膠質細胞的能力。
具有工程靶向能力的 EV 也已通過修飾生產細胞以產生具有糖基磷脂酰肌醇 (GPI) 錨定肽的重組 EGFR 特異性納米抗體來生產。由于 EV 富含 GPI,因此納米抗體在 EV 表面高度富集,這為 EV 提供了針對 EGFR+細胞的靶向特異性。雖然這兩種方法都成功地將 EV 靶向其預期的作用細胞,但生產細胞的基因修飾可能難以用于未來治療性 EV 的生產,因為它們的生產耗時且難以將其應用于源自細胞的細胞。患者自己的體液。
在 EV 生產后應用靶向組件是一個有吸引力的選擇,因為靶向配體可以以可控的方式以高密度應用。最近有許多通過在 EV 生產后添加納米抗體和抗體來賦予靶向能力的例子。例如,通過將靶向蛋白融合到乳粘素的 C1C2 結構域中,利用了 EV 膜中高濃度的 PS,后者以高親和力與 PS 結合。一種與 C1C2 融合的抗 EGFR 納米抗體自結合到 EV 膜上,并以劑量依賴性方式促進 EGFR+細胞對 EV 的攝取。
非靶向對照納米抗體融合蛋白不會改變與細胞的相互作用,并且融合蛋白的添加不會改變 EV 的大小或完整性,證明該方法適用于治療性 EV 靶向。通過將抗 Her2 單鏈可變片段融合到 C1C2 結構域來利用類似的方法。這種融合蛋白能夠鎖定在 EV 的表面上,并靶向將編碼前藥轉化酶的 mRNA 遞送至 Her2+細胞。值得注意的是,當與前藥一起給藥時,這些靶向 EV 幾乎能夠完全阻止原位 Her2+BT474 異種移植物在體內的生長。
除了抗體和納米抗體外,細胞外囊泡還通過靶向肽后期生產進行了功能化。例如,已經使用了一種能夠將自身錨定到 EV 膜上的多功能肽。該肽還含有針對在BBB和神經膠質瘤細胞上表達的低密度脂蛋白受體的序列和誘導細胞凋亡的序列。該肽含有與磷脂相關的 ApoA-I 模擬序列,并允許通過簡單的孵育將其摻入 EV。這種方法允許在大腦中積累全身注射的 EV,并成功地將載有甲氨蝶呤的 EV 靶向小鼠模型中的神經膠質瘤細胞,從而提高神經膠質瘤小鼠模型的存活率。除了此處描述的兩個之外,還有許多其他與 EV 表面連接的靶向肽示例,如表 3 所述。
表 3 添加肽的工程 EV 靶向示例

除了用作細胞靶向的介質外,肽還被用于促進 EV 被細胞吸收。例如,Nakase 等人,通過磺基-N-ε-馬來酰亞胺基己酰基-氧基磺基琥珀酰亞胺酯鍵,用富含精氨酸的微胞飲誘導肽修飾了 EV 的表面。這種修飾顯著增加了對 CHO-K1 細胞的吸收。
有趣的是,這種攝取的增加與負載的核糖體失活細胞毒性皂草素蛋白的遞送改善有關。這種細胞穿透肽的應用可能是改善治療性 EV 貨物的細胞內遞送的合適方法。
此外,同一組還能夠通過誘導 EGFR 的聚集和激活來促進 EV 的攝取。已知該受體的激活通過促進巨胞飲作用誘導 EV 攝取。受體 HeLa 細胞被設計為表達一種修飾形式的 EGFR,它以高親和力結合硬脂肽,該肽可以以高親和力錨定在 EV 膜上。這些經過修飾的 EV 能夠通過巨胞飲作用誘導受體聚集并促進攝取,并相應增加負載的皂苷活性。
除了使用靶向肽、納米抗體和抗體外,假型也被用于促進 EV 的吸收。假分型是一種經過充分研究的方法,通常用于病毒學,通過引入來自另一種不同病毒物種的外源蛋白質嗜性決定因素來改變病毒的嗜性。
研究人員利用這種方法在 HEK293 細胞中表達水泡性口炎病毒糖蛋白。選擇這種蛋白質是因為它通常用于增加治療性逆轉錄病毒載體的細胞向性和轉導效率。水泡性口炎病毒糖蛋白在 EV 的膜中表達,其胞外域負責誘導幾種不同細胞類型的攝取大量增加。
大多數旨在改變 EV 趨向性的研究都依賴于添加蛋白質或肽。然而,通過用陽離子支鏈淀粉修飾 EV 的表面,已經實現了對特定肝細胞的增強靶向性和 EV 攝取的增加。已知這種多糖與肝細胞上特異性表達的去唾液酸糖蛋白受體結合。用這種分子修飾 MSC 衍生的 EV 表面促進了體外攝取的增加。此外,在大鼠肝損傷模型中,普魯蘭修飾的 EV 靶向肝臟,顯著改善了肝功能的臨床參數
另一種不依賴蛋白質或肽的直接 EV 靶向的創新方法是通過添加能夠結合靶分子的核酸適體。這種方法最近被用于將 HEK293T 衍生的 EV 引導至前列腺癌細胞。
在這項研究中,噬菌體 phi29 馬達包裝 RNA 的三向連接 (3WJ) 被用作構建塊,膽固醇和前列腺特異性膜抗原 (PSMA) 特異性靶向適體融合到該構建塊上。當膽固醇與“箭頭”綁定時,3WJ 被加載到 EV 內部;然而,當膽固醇與“箭頭”結合時,3WJ 會顯示在 EV 表面。利用這一觀察結果來生產含有治療性抗存活素 siRNA 并在其表面顯示 PSMA 結合 RNA 適體的 EV。添加這種適體增加了 PSMA+細胞系的攝取并減少了小鼠異種移植模型中的腫瘤生長。除了 RNA 適體,DNA 適體也被用于指導 EV 靶向。核仁素特異性 DNA 適體 AS1411 用于將治療性 siRNA 靶向遞送至乳腺癌細胞表面表達的該蛋白質呈陽性的細胞。用這種適體修飾 EV 促進了體內腫瘤的遞送,這與抑制腫瘤生長有關。
EV 也被靶向而不添加靶向配體,而是通過添加磁性粒子。通過這種方式,可以使用定向磁場控制裝飾有磁性顆粒的細胞外囊泡的生物分布。例如,利用血液衍生的 EV 上豐富的轉鐵蛋白受體在其表面涂上轉鐵蛋白共軛的超順磁性納米顆粒。靜脈給藥后,這些顆粒的生物分布被成功控制并使用外部磁體靶向小鼠腫瘤。
盡管存在許多將 EV 靶向特定細胞類型或組織的例子,但已報道的 EV 靶向特定攝取途徑或亞細胞位置的例子相對較少。當用抗 Her2 抗體修飾時,EV 已被證明是針對特定的攝取途徑的。抗 Her2 定向 EV 與野生型 EV 和涂有非特異性抗體的 EV 顯示出不同的共定位模式。野生型 EV 主要與已知通過小窩介導的內吞作用吸收的蛋白質共定位,而非特異性抗體包被的 EV 與葡聚糖最強烈地共定位,后者被巨胞飲作用吸收。當分析抗 Her2 靶向 EV 時,它們與已知被大胞飲作用、小窩蛋白介導和網格蛋白介導的內吞作用吸收的標記物共同定位。
總而言之,這些觀察提供的證據表明,可以調整 EV 的攝取途徑和隨后的亞細胞目的地。這種調整可以通過避免降解攝取途徑來顯著提高 RNA 治療遞送的效率。
結論和觀點
近年來,已經報道了 EVs 作為細胞間通訊介質的重要性,并且已經證明 EVs 具有使其適合治療用途的幾個特征。由于這些原因,細胞外囊泡領域正在經歷一個快速增長的時期。這種增長與闡明 EV 的一些靶向能力、攝取途徑和生物分布特征的發現有關。
盡管最近取得了這些進展,但其基礎生物學的許多方面仍有待闡明。為了在治療環境中有效利用 EV,首先更好地了解它們的生物學方面將是非常有利的。
盡管已經有許多成功的嘗試來改變 EV 的生物分布和細胞靶向特性,但為了增加 EV 貨物向其細胞內作用部位的輸送而開展的工作相對較少。一個電池所占用的大部分細胞外囊泡可能注定要退化。因此,識別將允許改進貨物逃逸的特征將是非常有利的。
此外,EV 的吸收途徑非常多樣化,并且因細胞和 EV 類型而異。與其他途徑相比,特定的攝取途徑可能會導致向受體細胞輸送更大量的功能性貨物。如果將 EV 引導至細胞攝取機制,從而增加貨物的功能傳遞,則 EV 介導的治療策略的功效和效率將大大提高。
眾所周知,EV 制劑包含一系列 EV 亞型,這些亞型在亞細胞起源位點、大小和蛋白質標記方面有所不同。目前,將這些亞型分離以進行功能分析極具挑戰性,并且對在異質 EV 群體中發現的亞群的物理和功能特性的進一步表征仍在進行中。然而,出于治療目的對某些亞型的研究可能會導致發現其他有利的修飾或基于 EV 的治療策略。
總之,已經闡明了細胞外囊泡的攝取、生物分布、靶向和販運的許多方面。還進行了大量成功的研究,研究這些方法可以改變這些特征以產生有效的治療性 EV。然而,為了將這些發現轉化為臨床上成功的治療方法,需要進一步研究 EV 介導的貨物轉移和加工的潛在生物學。
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lcyj/9371.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃