關節炎 (OA) 是全球最流行的關節炎類型,會導致疼痛和慢性殘疾,并對全球醫療保健系統造成重大負擔。非甾體抗炎藥 (NSAID)、鎮痛藥、關節內注射皮質類固醇從長遠來看價值不大,而阿片類藥物可能會產生不良的后果。膝關節 OA 的放射治療價值有限。
物理治療、鍛煉、減肥和改變生活方式可以緩解疼痛、改善身體機能和生活質量。然而,沒有一種單一的治療方法具有再生受損關節軟骨的潛力。
由于對骨關節炎的更好理解,已經開發了創新的新治療方案。我們關注新興的 OA 膝關節治療、緩解癥狀和再生受損的關節軟骨,包括關節內人血清白蛋白、傳統的疾病緩解抗風濕藥 (DMARDs)、降脂劑 (他汀類藥物)、神經生長因子拮抗劑、骨形態發生蛋白、成纖維細胞生長因子、富血小板血漿 (PRP)、間充質干細胞 (MSC)、外泌體、白細胞介素 1 阻滯劑、基于基因的治療和雙膦酸鹽。
近兩年發表的關于外泌體的文章,如:Exosomes: roles and therapeutic potential in osteoarthritis 和 Emerging and New Treatment Optiones for Knee Osteoarthritis 報道和綜述了外泌體在骨關節炎中的作用和治療潛力,為關節炎治療提供了新的解決方案。

2021 Nov 15.doi: 10.2174/1573397117666211116111738.?nline ahead of print.
Curr Rheumatol Rev.

Exosomes: roles and therapeutic potential in osteoarthritis
外泌體:骨關節炎中的作用和治療潛力
人類關節腔中可檢測到外泌體
外泌體通過調節細胞間通訊參與許多生理和病理過程,這些過程涉及許多疾病,包括骨關節炎(OA)。在人類關節腔中可檢測到外泌體,并觀察到隨著 OA 的進展而發生變化。幾種關節細胞,包括軟骨細胞、滑膜成纖維細胞、成骨細胞和肌腱細胞,可以產生和分泌影響靶細胞生物學效應的外泌體。此外,來自干細胞的外泌體可以通過促進軟骨修復、抑制滑膜炎和介導軟骨下骨重塑來保護 OA 關節免受損傷。
骨關節炎治療存在的問題
骨關節炎 (OA) 是一種高度流行的退行性關節疾病,影響全球超過 3 億人。OA 引起的慢性疼痛和運動功能障礙嚴重降低了患者的生活質量。此外,OA給患者和社會帶來的社會經濟負擔相當大。目前的 OA 管理大致分為非藥物治療、藥物治療和手術治療。?非藥物治療,如運動、減肥和物理治療,被建議作為早期 OA 患者的適當治療。藥物治療主要旨在實現疼痛控制,以提高日常生活的功能和質量。手術治療最廣泛用于患有嚴重功能障礙的終末期患者。目前,改善關節穩態和延緩 OA 進展的令人滿意的策略很少。
外泌體被認為是參與許多生理和病理過程的細胞間通訊的重要介質。最近,外泌體在 OA 中的作用和治療潛力在這一領域得到了越來越多的關注。
外泌體,細胞間通訊介質
細胞外囊泡 (EV) 是膜結合載體,可分為三種類型,包括外泌體、微囊泡 (MV) 和凋亡小體。作為一種重要的 EV,外泌體在過去十年中受到了最多的關注。外泌體可以由各種細胞分泌,并通過其內容物(包括脂質、核酸和蛋白質)介導細胞間通訊。
外泌體的直徑通常在30-150 nm之間,密度在1.13-1.19 g·mL-1.19之間。發現脫落的膜囊泡可能具有生理功能,并建議將這些囊泡作為外泌體。1983 年,Harding 等人。觀察到膜結合囊泡可以通過多囊泡內體 (MVE) 胞吐作用釋放。后來,研究人員發現轉鐵蛋白受體可以從細胞表面轉移到內部囊泡中形成 MVE。1987 年,Johnstone 等人。觀察到網織紅細胞成熟過程中的外泌體釋放與質膜活性有關。Raposo 等人。后來發現外泌體在抗原呈遞和 T 細胞活化中起重要作用。然后,外泌體與腫瘤之間的關系被報道。2007 年,Valadi 等人。發現 mRNA 和 microRNA 可以通過外泌體發送到其他細胞,表明外泌體可能通過遞送核酸來介導細胞間通訊。此后,越來越多的研究表明外泌體通過介導細胞間通訊發揮重要的生理和病理作用。
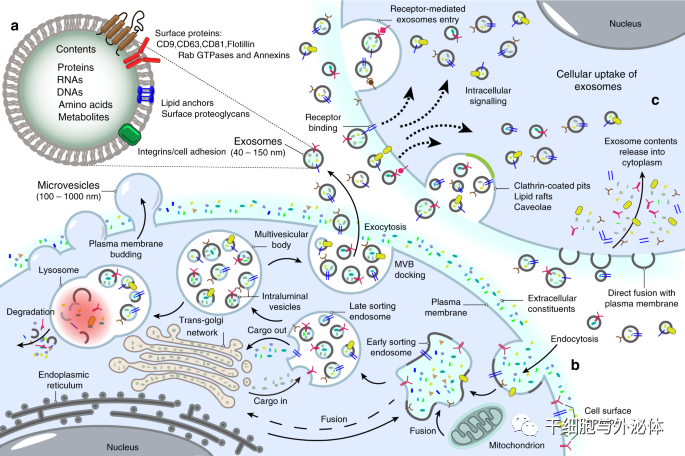
外泌體的產生過程
外泌體的分離方法
具有高純度的外泌體的富集是基礎研究的關鍵步驟和外泌體的進一步臨床應用。目前,已經基于外泌體的尺寸,形狀,密度和表面蛋白,開發了不同的外部分離方法,包括超速離心,基于尺寸的技術,免疫親和純化,沉淀和基于微流體的分離技術。這些方法具有自身的優點和缺點,需要進一步改善,以促進外來物質的研究及其應用。
干細胞衍生外泌體對OA的治療效果
在過去的幾十年中,已經發現外泌體通過外泌體含量影響了幾種生理和病理過程,包括RNA,DNA,蛋白和脂質。迄今為止,累積證據表明外泌體參與許多生物過程,包括血管生成,細胞分化,免疫調節,代謝平衡和發育,并且涉及許多疾病,如癌癥,神經變性疾病,自身免疫疾病和心血管疾病。最近,外泌體在骨穩態中的作用得到了廣泛的解決。
干細胞如骨髓間充質干細胞(BMSCs)和脂肪間充質干細胞(AMSCs)表現出有效的軟骨再生能力,并已針對OA治療的OA治療臨床試驗臨床測試。表現出可靠的安全性和可行性,而這種方法可以改善膝關節社會臨床評級系統(KSS)和OA結果得分,并部分緩解膝關節疼痛。但是,其基于干細胞的OA治療的詳細機制沒有得到很好的澄清。越來越多的研究表明,干細胞的治療效果主要取決于干細胞的靜脈功能,包括迄今為止的EVS的分泌,已揭示來自不同類型干細胞的外泌體來調節軟骨再生和在某些模型中衰減OA進展。
來自骨髓間充質干細胞的外泌體
源自 BMSC 的外泌體可以影響細胞命運,包括細胞凋亡、增殖、侵襲和遷移。此外,源自 BMSC 的外泌體可以調節多種生理和病理過程,包括免疫反應、成骨、纖維化和血管生成。幾項研究報告稱,BMSC 衍生的外泌體顯著促進受損組織的再生和修復,包括軟骨和軟骨下骨。來自 TGFβ3 預處理的 BMSC 的外泌體以及 MV/微粒 (MP) 顯著增加了骨關節炎軟骨細胞中合成代謝標記的表達并降低了分解代謝標記基因的水平。此外,這些 BMSC 衍生的外泌體可以防止骨關節炎軟骨細胞發生細胞凋亡。
來自滑膜間充質干細胞的外泌體
滑膜間充質干細胞 (SMSC) 在體外顯示出更好的軟骨分化能力。研究發現來自 OA 或 RA 患者的 SMSCs 可以在體外和體內使用同種異體組織工程構建體有效增強軟骨修復。在實驗動物模型中,關節內注射 SMSCs 可以顯著促進軟骨修復并用于治療關節相關疾病,包括 OA。此外,SMSC-140-Exo 治療顯著減輕了大鼠 OA 模型中的關節磨損,降低了 OARSI 評分并延遲了 OA 進展。
來自脂肪組織間充質干細胞的外泌體
脂肪組織間充質干細胞 (AMSCs) 被證明具有強大的軟骨再生和炎癥調節能力,被認為是 OA 治療的極好細胞來源。然而,AMSC 誘導軟骨再生的機制仍不清楚。越來越多的證據表明,AMSCs 可能主要通過旁分泌營養因子來調節局部微環境,從而防止軟骨侵蝕并改善關節功能,使其更利于修復和再生。據報道,EVs,包括 MVs 和外泌體,主要介導 AMSCs 對骨關節炎成骨細胞的旁分泌作用。
此外,AMSC 衍生的 MV 和外泌體可以抑制促炎介質的產生,如 TNF-α、IL-6、PGE2 和 NO,以及 MMP 活性和 MMP-13 水平,同時增加抗炎細胞因子 IL 的水平-10 和 OA 軟骨細胞中的軟骨細胞特異性分子膠原蛋白 II,209 這表明 AMSC 衍生的 MV 和外泌體具有潛在的抗炎和軟骨保護作用。
來自胚胎間充質干細胞的外泌體
Exosomes from embryonic mesenchymal stem cells
胚胎間充質干細胞被認為是軟骨再生和骨關節炎治療的另一種潛在候選者。最近,一些研究表明,胚胎間充質干細胞的外泌體明顯調節了軟骨細胞的生物學表型并延遲了骨關節炎實驗模型中的骨關節炎進展。實驗人員成功地從 HuES9 人類胚胎干細胞 (hESCs) 中分離并鑒定了外泌體。
將 hESC 衍生的外泌體關節內注射到大鼠的骨軟骨缺損中后,他們觀察到軟骨和軟骨下骨的損傷在 6 周時基本逆轉,并在 12 周時幾乎完全恢復,表明胚胎 MSC 外泌體(MSC-Exos)可能是軟骨修復和關節相關疾病的無細胞治療替代方案。
同樣,在大鼠骨軟骨缺損模型中,來自 E1-MYC 16.3 人胚胎干細胞來源的 MSC 的外泌體在 12 周和 6 周時增強了與鄰近宿主軟骨的整合和表面規律。此外,這些外泌體早在 2 周就顯著促進了新組織形成和細胞外基質沉積,增加了 M2 巨噬細胞浸潤,并減少了 M1 巨噬細胞和促炎細胞因子的產生。
該研究還表明,胚胎 MSC 衍生的外泌體可以被軟骨細胞內吞,通過腺苷依賴性 AKT 和 ERK 信號通路調節軟骨細胞遷移、增殖和基質合成。
在 DMM 誘導的 OA 模型中,來自人類胚胎干細胞誘導的間充質干細胞 (ESC-MSC) 的外泌體在關節內注射 4 周后顯著阻止了軟骨破壞和基質降解。
此外,來自胚胎間充質干細胞的外泌體在免疫正常大鼠顳下頜關節的OA模型中可以減少炎癥反應,緩解早期疼痛,促進軟骨修復和軟骨下骨愈合。
胚胎 MSC 衍生的外泌體逆轉了 IL-1β 介導的對 s-GAG 合成的抑制,并通過腺苷介導的 AKT、ERK 和 AMPK 激活減少了 IL-1β 誘導的一氧化氮和 MMP13 的產生。220 此外,TGF- β1 增強了胚胎 MSC 衍生的外泌體中 miR-135b 的表達,這可能通過降低 Sp1 的表達和加速大鼠 OA 模型中的軟骨修復來促進軟骨細胞增殖。
展望
作為一種重要的細胞間通訊介質,外泌體極大地促進了 OA 的發生和進展,并已顯示出用于 OA 治療的強大潛力。探索外泌體在 OA 病理變化中的詳細機制將有助于我們篩選和識別潛在的治療靶點。此外,我們需要優化 MSC-Exos 以提高其對 OA 的治療效果。關于外泌體在 OA 中的作用、潛在機制和診斷/治療應用的研究才剛剛開始,該領域仍有許多問題需要解決。隨著技術的進步,我們推測未來基于外泌體的治療將應用于 OA 患者。
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lcyj/6935.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃