
生命科學Life science
5月14日,北京大學生命科學學院和北京大學-清華大學生命科學聯(lián)合中心研究員杜鵬研究員在Cell Press旗下期刊Cell上在線發(fā)表了題為“Mouse totipotent stem cells captured and maintained through spliceosomal repression”的研究論文,課題組通過抑制剪接體,首次實現(xiàn)了小鼠全能性干細胞的體外建立和培養(yǎng),且這種細胞在分子特征和發(fā)育潛能上接近體內(nèi)2細胞和4細胞時期胚胎,因此被命名為totipotent blastomere-like cells(TBLCs)。
干細胞研究的核心問題之一是如何在體外捕獲和維持具有更高分化潛能的胚胎干細胞。1981年,Evans和Martin首次從小鼠的囊胚中成功分離得到了多能性胚胎干細胞。直到今天,所有培養(yǎng)的小鼠胚胎干細胞都處于多能狀態(tài),其分化潛能是受限制的,只能發(fā)育到胚內(nèi)組織的細胞,而不能發(fā)育到胚外組織。多能性干細胞對應(yīng)體內(nèi)的內(nèi)細胞團和上胚層細胞。只有體內(nèi)的合子、2細胞和4細胞能夠發(fā)育到胚內(nèi)和胚外組織,人們稱這一時期的細胞為全能性干細胞。人們一直致力于在體外培養(yǎng)全能性干細胞。2C-like細胞是最早報道的能夠產(chǎn)生胚內(nèi)和胚外組織的細胞。但是,這種細胞在培養(yǎng)基中是亞穩(wěn)態(tài)的,僅以極低的百分比(0.1%-1%)存在。2017 年,兩個研究小組報道使用不同的化學小分子混合物建立了擴展型多能干細胞(Expanded (or extended) pluripotent stem cell, EPSC),可以發(fā)育產(chǎn)生胚內(nèi)和胚外組織。但是,這種擴展型多能干細胞的分子特征和發(fā)育潛能等方面和體內(nèi)真正的全能性胚胎細胞仍存在較大差距。迄今為止,人們無法在體外捕獲和維持分子和功能上與體內(nèi)2-4細胞時期相似的全能性干細胞,因此也就無法真正利用體外細胞培養(yǎng)體系研究著床前胚胎發(fā)育過程,并且導(dǎo)致胚外組織的體外分化及相關(guān)轉(zhuǎn)化醫(yī)學應(yīng)用等方面也存在極大的局限性。
近幾年的研究表明,各種 RNA 調(diào)控通路在早期胚胎發(fā)育和干細胞分化中起著重要作用,信使RNA剪接是一個最基本的生物學過程,在本研究中,研究人員發(fā)現(xiàn)剪接因子在早期胚胎發(fā)育中存在一個動態(tài)變化過程。有一類剪接因子在胚胎發(fā)育前期(全能性細胞時期)低表達,而后期(多能性細胞時期)高表達。因此猜想,敲低或抑制這部分剪接因子能否能推動多能性干細胞轉(zhuǎn)變?yōu)槿苄愿杉毎W罱K發(fā)現(xiàn),瞬時敲低小鼠胚胎干細胞剪接體的不同核心亞基的十個剪接因子可以通過廣泛激活全能性基因并抑制多能基因來驅(qū)動多能干細胞向全能干細胞的轉(zhuǎn)變。此外,通過將剪接抑制劑Pladienolide B(PlaB)添加到Serum/ LIF培養(yǎng)基中(SLP培養(yǎng)基),研究人員實現(xiàn)了將多能干細胞重新編程為全能干細胞,且得到的 TBLC細胞可以在體外穩(wěn)定培養(yǎng)多代。
為了證明體外培養(yǎng)的TBLCs的全能性,研究人員通過單細胞測序,說明了SLP培養(yǎng)基能培養(yǎng)和維持TBLCs細胞的同質(zhì)性。還利用轉(zhuǎn)錄組、翻譯組、DNA甲基化組和染色質(zhì)可及性測序,表征了 TBLCs 的分子特征,發(fā)現(xiàn)其在多組學水平上均與全能性胚胎時期相似。此外,研究人員在轉(zhuǎn)錄組上比較了TBLCs與EPSCs和2C-like細胞,發(fā)現(xiàn)相比于EPSCs和2C-like細胞,TBLCs明顯靠近2細胞和4細胞胚胎。
為了證明TBLCs的發(fā)育潛能,研究人員通過進一步的嵌合實驗表明TBLCs可以嵌合到小鼠的整個囊胚,E6.5-E7.5時期胚胎以及發(fā)育后期的胎兒,胎盤和卵黃囊。且令人驚訝的是,單個 TBLC細胞就能夠廣泛嵌合到E6.5-E7.5胚胎的EPC、ExE和 EPI 組織,有力地證明了其強大的胚內(nèi)和胚外雙向發(fā)育潛能,且接近體內(nèi)全能性胚胎。
以往通過免疫染色證明細胞的發(fā)育潛能等方式存在假陽性等問題,為了更嚴格的定義TBLCs在發(fā)育潛能上的全能性,研究人員首次利用單細胞測序方法,準確追蹤出供體細胞的發(fā)育譜系,證明TBLCs能夠在胎盤和卵黃囊中分化為至少6種胚外和15種胚內(nèi)細胞類型,直接驗證了 TBLCs具有“真正的”全能發(fā)育能力。這為全能性細胞的功能性檢驗提供了一個更嚴格的檢驗方法。因此,迄今為止,TBLCs是唯一的,在分子特征和發(fā)育潛能上與全能性胚胎相當?shù)模w外捕獲的全能干細胞。
由于材料難以獲得,體內(nèi)著床前胚胎發(fā)育過程往往難以研究。建立一個相應(yīng)的體外模擬體系將有力地推動該領(lǐng)域的發(fā)展,但該體系受限于缺乏關(guān)鍵的全能干細胞。為了解決這一問題,研究人員將TBLCs培養(yǎng)基中撤去PlaB后,發(fā)現(xiàn)TBLCs能夠轉(zhuǎn)變到多能性細胞。因此本研究為研究著床前胚胎發(fā)育提供了一個可靠的體外系統(tǒng)。
最后為了解答為何抑制剪接體能夠使多能性細胞轉(zhuǎn)變?yōu)槿苄裕芯咳藛T通過瞬時高濃度PlaB處理,觀察到短時間內(nèi),剪接體抑制導(dǎo)致多能性基因廣泛的內(nèi)含子積累和剪接效率的急劇降低,最終多能性基因的表達減少。然而,全能性基因仍被有效剪接且轉(zhuǎn)錄激活,這與其內(nèi)含子少而短的獨特基因特征有關(guān),但是更詳細的機制還需要繼續(xù)探索。
杜鵬研究員表示,此項研究首次建立了體外捕獲和培養(yǎng)全能性干細胞的方法,而且令人驚奇地揭示了剪接體在干細胞命運轉(zhuǎn)變中的重要決定作用。故此,該成果不但對于早期胚胎發(fā)育相關(guān)的基礎(chǔ)研究提供了新的體外研究體系,同時也為未來干細胞相關(guān)的臨床醫(yī)學研究提供了新型的發(fā)育潛能極高的“種子細胞”來源。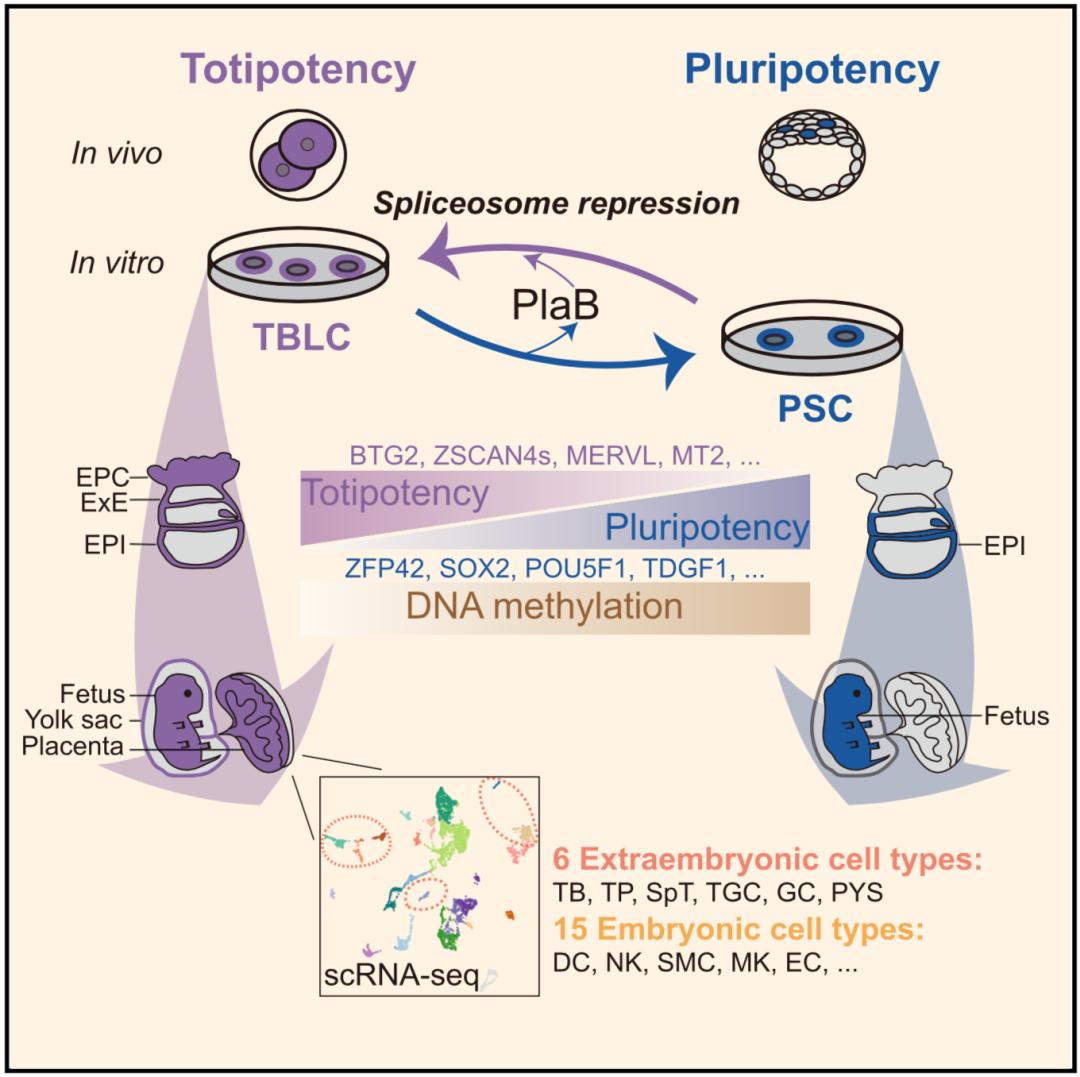 作者專訪
作者專訪
Cell Press細胞出版社特別邀請論文通訊作者杜鵬研究員代表團隊進行了專訪,請他為大家進一步詳細解讀。
CellPress:
干細胞研究與癌癥、再生醫(yī)學等息息相關(guān),能夠為人類攻克疑難雜癥提供重要助力,那么干細胞在體外獲取及全能性維持等方面的難點在哪里?
杜鵬研究員:
由于干細胞具有天然的分化特性,因此干細胞在體外獲取和培養(yǎng)的基本原理是在培養(yǎng)基中加入阻止干細胞分化的抑制劑,讓干細胞處于只能自我更新而不能分化的狀態(tài),從而實現(xiàn)了干細胞的培養(yǎng)。因此,理解干細胞分化的核心信號通路,并進而對其抑制是干細胞培養(yǎng)的關(guān)鍵也是難點。迄今為止,人們對于多能性(pluripotent)胚胎干細胞分化所依賴的重要信號通路已經(jīng)較為清楚,以此為基礎(chǔ),研究者通過組合不同通路的抑制劑從而開發(fā)出了不同的多能性干細胞的培養(yǎng)體系,比如2i/LIF, LCDM等培養(yǎng)條件。然而哺乳動物體內(nèi)全能性胚胎細胞是處于合子基因組激活(zygote genome activation,ZGA)時期。這一時期的細胞數(shù)量極為有限,導(dǎo)致人們很難在分子生化層面上對關(guān)鍵的調(diào)控機制進行深入的研究,所以對于全能性細胞分化的關(guān)鍵調(diào)控通路一直知之甚少。因此也就很難針對性的利用相關(guān)的抑制劑實現(xiàn)對于全能性干細胞的培養(yǎng)。在這項研究中,我們結(jié)合自己的偶然發(fā)現(xiàn),剪接體核心基因在早期胚胎發(fā)育中的動態(tài)表達變化和已發(fā)表的全局性基因篩選獲得的靶基因中包含大量剪接體基因這三方面的現(xiàn)象,推測剪接體的動態(tài)變化很可能是決定胚胎干細胞全能性狀態(tài)和多能性狀態(tài)轉(zhuǎn)化的關(guān)鍵。在實驗驗證的基礎(chǔ)上最終通過使用剪接體抑制劑實現(xiàn)了小鼠全能性干細胞的培養(yǎng)。當然得到全能性干細胞的途徑可能不止抑制剪接體這一條,更多的途徑還需要進一步探索。
CellPress:
請問細胞多能性和全能性的區(qū)別都有哪些?
杜鵬研究員:
在分子特征上,小鼠多能性干細胞是從囊胚的內(nèi)細胞團或者上胚層分離而來,因此分子水平整體上靠近囊胚或者胚胎剛剛植入時期,表達一些多能性標記基因,如基因Oct4, Sox2,Nanog等。全能性干細胞分子水平整體上接近胚胎2/4細胞時期,高表達Zscan4s,Btg1/2等基因,激活Mervl,Mt2轉(zhuǎn)座子表達。全能性干細胞不再激活多能性標記基因的表達,也是全能性干細胞不同于以往報道的全能性相似細胞(比如2C-like細胞,EPSC等)的主要特征。從發(fā)育潛能來看,全能性細胞具有最高的發(fā)育潛能,可以分化發(fā)育到胚內(nèi)組織和胚外組織。我們首次從單細胞水平證明了TBLC可以分化到6種以上的胚外和15種以上的胚內(nèi)細胞譜系。而多能性細胞的發(fā)育潛能是受限的,只能發(fā)育到胚內(nèi)組織。
CellPress:
剪接體抑制是如何將多能干細胞重編程為全能干細胞的?
杜鵬研究員:
這是非常好的一個問題。我們發(fā)現(xiàn)同果蠅中的報道一致,小鼠中合子基因組激活時期特異表達的全能性基因和其它基因相比,具有內(nèi)含子較短,數(shù)量較少的特點。進而根據(jù)現(xiàn)有的測序數(shù)據(jù)和體外報告基因系統(tǒng),我們推測很可能以上全能性基因的獨特特征是其對于剪接體的需求和其它基因不同的原因,從而導(dǎo)致剪接體抑制廣泛造成多能性基因不能有效剪接,進而導(dǎo)致mRNA的降解,但全能性基因的剪接卻不受影響,且轉(zhuǎn)錄被激活。因此胚胎干細胞脫離了原來的多能性狀態(tài)并向全能性轉(zhuǎn)化。當然具體的機制還需要我們更為深入的研究。
CellPress:
利用剪接體抑制劑,Pladienolide B (PlaB),體外獲得的全能囊胚樣細胞(TBLCs)有何特點?
杜鵬研究員:
首先,在轉(zhuǎn)錄組,翻譯組,DNA甲基化組和染色質(zhì)可及性上, TBLCs與2細胞和4細胞胚胎時期相似;其次,TBLCs具有胚內(nèi)和胚外的雙向分化潛能,能夠產(chǎn)生多種胚內(nèi)和胚外細胞譜系;最后,TBLCs細胞能夠轉(zhuǎn)換到多能性狀態(tài),在分子水平上模擬從體內(nèi)2細胞時期到囊胚時期的發(fā)育。
CellPress:
全能性基因和多能性基因?qū)艚芋w抑制劑處理的反應(yīng)有何差異?
杜鵬研究員:
我們使用了一個高濃度的PlaB瞬時處理系統(tǒng)來追蹤由于剪接體抑制直接引起的多能性和全能性基因的改變。通過這個瞬時系統(tǒng),我們觀察到剪接體抑制導(dǎo)致多能性基因廣泛的內(nèi)含子積累和剪接效率的急劇降低,最終多能性基因的表達減少。然而,全能性基因仍被有效剪接,這與其內(nèi)含子少而短的獨特基因特征有關(guān)。同時令人驚奇的是,我們也發(fā)現(xiàn)剪接體的抑制還可以大量激活全能性基因的表達,盡管其中的具體機制我們還需要深入探究。
CellPress:
請問本研究能夠為干細胞研究方面提供怎樣的幫助?
杜鵬研究員:
首先,我們首次揭示了剪接體在干細胞命運轉(zhuǎn)變中的重要決定作用,不僅拓寬了我們對 RNA 調(diào)控在細胞命運決定中作用的認識,而且加深了我們對剪接體和胚胎發(fā)育的理解。其次,我們發(fā)現(xiàn)可以通過簡單地在 Serum/ LIF 培養(yǎng)基中操縱PlaB輕松實現(xiàn)全能性和多能性細胞的轉(zhuǎn)換,從而為著床前胚胎發(fā)育研究提供了一個可靠的體外系統(tǒng)。最重要的是,我們?yōu)槲磥砀杉毎嚓P(guān)的臨床醫(yī)學研究提供了新型的發(fā)育潛能極高的“種子細胞”來源。 作者介紹
作者介紹 杜鵬
杜鵬
研究員
杜鵬博士,2012年于北京大學獲得博士學位,后進入哈佛大學醫(yī)學院/波士頓兒童醫(yī)院從事博士后研究。2018年9月起任北京大學生命科學學院和北京大學-清華大學生命科學聯(lián)合中心研究員。杜鵬博士長期從事鑒定未知RNA調(diào)控通路,并研究其在胚胎干細胞和早期胚胎發(fā)育中功能的相關(guān)研究,在Cell,Nature,Cell stem Cell, Molecular Cell, PNAS,PLoS Pathogen等國際學術(shù)期刊上發(fā)表多篇論文。
杜鵬課題組的研究集中在RNA生物學與干細胞生物學。綜合運用傳統(tǒng)的生物化學,分子生物學,結(jié)合高通量測序,基因組學,生物信息學等手段來分析和鑒定未知的RNA調(diào)控通路,研究相關(guān)RNA調(diào)控通路在胚胎干細胞的分化命運決定和早期胚胎發(fā)育中的功能。同時,致力于在動物細胞中重組植物或微生物中特異的RNA調(diào)控通路,并分析其潛在的對于基礎(chǔ)科學研究和轉(zhuǎn)化醫(yī)學研究中的價值。
相關(guān)論文信息
論文原文刊載于CellPress細胞出版社旗下期刊Cell 上,點擊“閱讀原文”或掃描下方二維碼查看論文
▌?wù)撐臉祟}:
Mouse totipotent stem cells captured and maintained through spliceosomal repression
▌?wù)撐木W(wǎng)址:
https://www.cell.com/cell/fulltext/S0092-8674(21)00500-6
▌DOI:
https://doi.org/10.1016/j.cell.2021.04.020
編輯:小果果,轉(zhuǎn)載請注明出處:http://www.448371.com/linchuang/lcyj/3435.html
免責聲明:本站所轉(zhuǎn)載文章來源于其他平臺,主要目的在于分享行業(yè)相關(guān)知識,傳遞當前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請及時告知,我們會在24小時內(nèi)刪除相關(guān)信息。
說明:本站所發(fā)布的案例均摘錄于文獻,僅用于科普干細胞與再生醫(yī)學相關(guān)知識,不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃 





