前言
上一章我們了解了細胞表面的受體廣泛地接收信號并把信號轉導到細胞質內,這一章我們將要探討這些大部分由生長因子受體發出的信號是如何被加工并整合入細胞質中的。這些信號在加工后大多被傳遞到細胞核中,在那里它們為細胞增殖提供重要的調控信號。
癌癥是一種細胞增殖失控的疾病,我們常常可能會認為癌細胞創建了全新的調控自身生長和分化的方式。然而,事實上,癌細胞和正常細胞利用幾乎完全相同的調控網絡,癌細胞僅僅對細胞內現有的調控機制稍加改變。它們只稍微調整了一下已有的調控系統,而不是破壞其全部機制或重新組裝一個新系統。
從某種意義上來說,癌癥確實是一種增殖異常的疾病。但當我們更加深入地了解癌細胞時,我們將會在另一個層面上了解到:癌癥實際上是一種信號加工異常的疾病。
Ras蛋白的中心位置
細胞對于對于生長因子的不同反應給那些對胞內信號轉導感興趣的人帶來了挑戰,因為此前對胞內交互信號通路的組織及功能幾乎一無所知。經過了大約10年,這些通路慢慢地像一個游戲拼圖那樣被拼湊起來,故事的主人公就是Ras蛋白。
一個完全未預料到的領域進展揭示了Ras的作用機制。果蠅眼部發育的遺傳學研究顯示,一系列基因產物對果蠅復眼的光感原件的正常發育起關鍵作用,其中一個重要的基因被稱為Sevenless。研究者發現Sevenless基因編碼的蛋白質含有酪氨酸激酶受體普遍存在的結構。
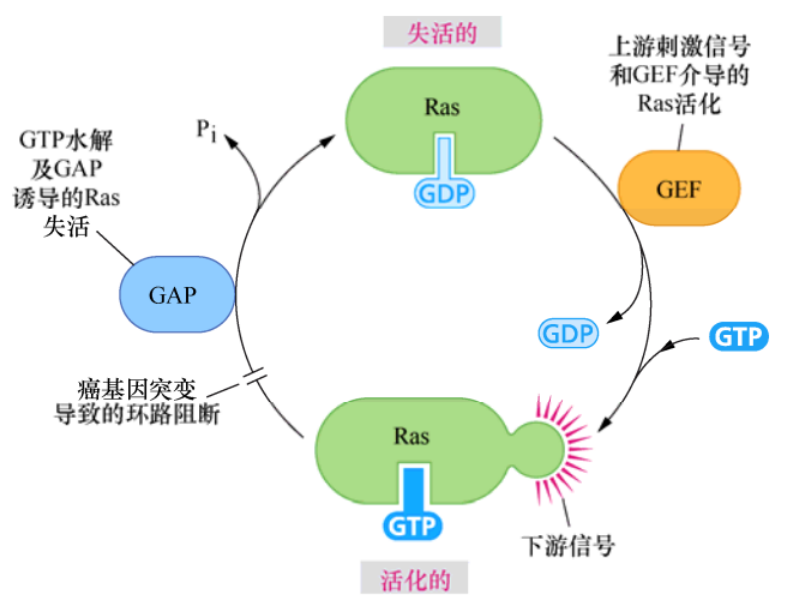
Sevenless的一個下游蛋白是由一個名為Son of sevenless簡稱sos的基因編碼的,密切觀察酵母的生化過程,發現Sos蛋白與參與激活核苷酸交換的G蛋白如Ras有關。這些酵母蛋白,通常被稱為鳥嘌呤核苷酸交換因子(GEF),可通過誘導G蛋白釋放GDP,以便為GTP的結合提供位點。
? ? ? ? ? ? ? ? ? ?
這樣便可將這些G蛋白從無活性狀態誘導為活化的、可釋放信號的構象。而這個精細的反應是Sos作用于Ras之后的結果。因此,Sos就是長期以來尋找的可將Ras轉化為活性狀態的上游刺激因子,是調控Ras的關鍵組分。
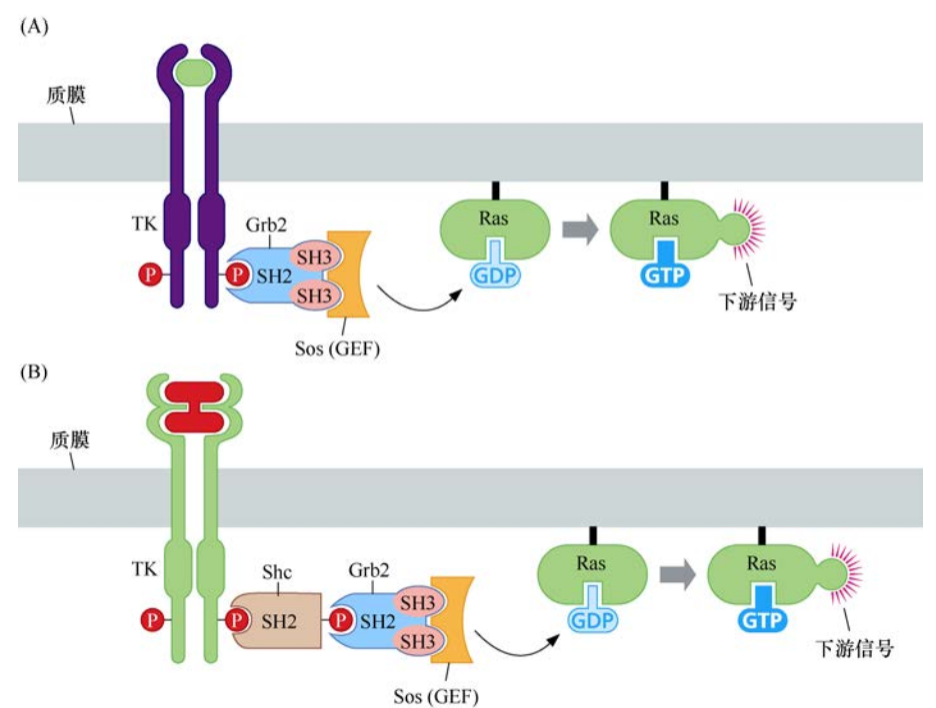
之后陸續發現了信號級聯中的其他中間分子。其中的兩個(Shc和Grb2)是通過對磷酸化受體或衍生肽有相互作用的蛋白質,進行遺傳和生化篩選而發現的。這些蛋白質的功能是作為接頭蛋白,在生長因子受體和Sos之間起橋聯作用。
這樣,經過遺傳和生化數據的糅合,提示人們有這樣一條線性信號級聯:酪氨酸激酶受體-Shc-Grb-Sos-Ras。
SH2和SH3結構域
酪氨酸的磷酸化非常重要,但它是如何激活下游復雜的信號通路的呢?人們提出了2個模型,一個認為酪氨酸磷酸化可以改變蛋白質的構象,使之處于活化狀態;而另一種認為酪氨酸磷酸化影響的是下游信號分子的定位,而不是它們的活性。一旦它們重新定位于胞質內的新位點,這些下游分子就可向胞內的其他靶點釋放信號。
結果顯示,第二種模型,包含蛋白質的重新定位被證明是更加重要的。研究人員發現了3種不同的氨基酸序列結構域,每一種都既存在于Src蛋白中,又存在于其他的無關蛋白質中。這些序列被稱為Src的同源結構域1、2、3(SH1、SH2、SH3),對于解開受體信號通路這個謎題起了關鍵的作用。
Src蛋白的SH1結構域代表了它的催化結構域,SH2結構域作為內部的“受體”發揮作用。SH2受體的配體是一個短肽序列,它包含磷酸化的酪氨酸及其C端一個3-6個殘基的特異多肽序列。迄今為止,已發現存在許多不同的SH2結構域,預計人類基因組可編碼至少120種不同的SH2結構域。
SH2結構域的相關發現最終回答了酪氨酸激酶受體是如何發出信號的。配體誘導的受體轉磷酸作用的結果是受體分子胞內區產生特征性的磷酸酪氨酸殘基譜。這些磷酸酪氨酸殘基對各種含SH2的胞內蛋白質具有親和力,于是,在被配體結合激活后不久,一個生長因子受體就被一系列伴侶蛋白——通過SH2結構域結合到其磷酸化酪氨酸殘基上所修飾。
由于酪氨酸激酶受體胞內的結構域位于質膜內表面,由受體募集而來的含SH2的蛋白也就貼近質膜。這種靠近使得各種含SH2蛋白可直接與質膜相關蛋白或磷脂相互作用,故而產生一系列生化信號,并通過各種信號級聯傳遞下去。
SH3結構域是Scr蛋白中的第三個序列模板,它能特異地結合伴侶蛋白中的富含脯氨酸序列結構域,這些富含脯氨酸的序列就作為SH3結構域配體來發揮作用。
? ? ? ? ? ? ? ? ?
SH2和SH3結構域解釋了生長因子受體如何激活Ras并獲得信號傳遞的特異性。Grb2包含兩個SH3結構域和一個SH2結構域,它的SH3結構域對Sos中兩個不同的富含脯氨酸的序列具有親和力,而它的SH2結構域則可與眾多生長因子激活受體的C端的磷酸化酪氨酸結合。一旦Sos蛋白通過Grb2(或者Grb2和Shc)與受體連接,它與Ras蛋白的距離就會被拉近,而大部分Ras蛋白都被永久性地錨定于質膜內側。Sos與Ras分子的直接相互作用誘導后者釋放GDP并結合GTP。這種鳥嘌呤核苷酸的轉換使Ras蛋白通路的信號激活。因此,這條生化通路可顯示如下:受體-Grb2-Sos-Ras或者受體-Shc-Grb2-Sos-Ras。
Ras調控的信號通路

激酶級聯
第一個被發現的Ras效應分子是Raf激酶,Raf磷酸化底物蛋白的絲氨酸和蘇氨酸殘基。Raf活化后通過磷酸化激活第二個激酶MEK。MEK實際上是一種“雙特異性激酶”,既可以磷酸化絲氨酸/蘇氨酸殘基,又可以磷酸化酪氨酸殘基。MEK利用這兩種功能來磷酸化另外兩種激酶,胞外信號調控激酶1和2(Erk1和Erk2)。一旦被活化,每一種Erk都可以磷酸化底物,然后調節包括轉錄在內的各種胞內進程。
這種激酶信號級聯通常稱為MAPK通路。實際上,在哺乳動物細胞中存在一系列這樣的信號級聯。Raf起始的信號級聯下游的Erk1和Erk2可以稱為MAPK;磷酸化MAPK的激酶通常稱為MAPKK,MEK行使這個MAPKK的功能;磷酸化MAPKK的激酶則通常稱為MAPKKK,Raf可以認為是一種MAPKKK。
Ras-Raf-MEK-Erk通路只是GTP結合的Ras蛋白活化的下游信號級聯之一。這條激酶級聯在細胞轉化中非常重要,因為在許多種細胞中轉導入突變的致癌Raf蛋白激酶時,能夠誘導出Ras癌蛋白引起的大部分轉化表型。因此,在這些細胞中,Raf通路是Ras癌蛋白轉化能力的重要執行者。
PI3K和Akt/PKB激酶
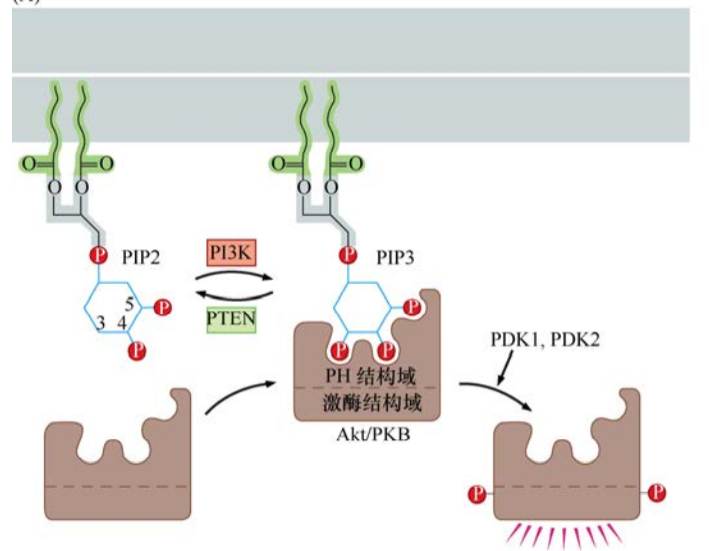
Ras蛋白的另一個重要的下游效應分子是調控肌醇脂類和Akt/PKB激酶,產生的效應就是抑制細胞凋亡,這種抗凋亡的活性對于癌細胞及其關鍵。
目前已知磷脂的肌醇部分能被幾種不同的激酶修飾,在已發現的幾種磷脂酰肌醇3(PI3)激酶中,最重要的可能是磷酸化PI(4′, 5’)P2(又稱PIP2)的PI3K。PIP2經PI3K修飾后變成了PIP3。PIP3的肌醇頭部在3,4,5位都帶有一個磷酸,似乎是磷酸化肌醇最重要的組成基團。許多與PIP3作用的胞漿蛋白都有一個pleckstrin同源(PH)結構域,這個結構域對三磷酸化的肌醇頭部有很強的親和力。
Akt又稱為蛋白激酶B(PKB),是一種含有PH結構域的絲氨酸/蘇氨酸激酶。PI3K催化PIP3生成一個細胞內含PH結構域蛋白的錨定位點,Akt/PKB激酶一旦通過其PH結構域錨定在細胞膜內表面,Akt/PKB就被其他兩種激酶(PDK1、PDK2)磷酸化而激活。
? ? ? ? ? ? ? ? ?
磷酸化激活后,Akt/PKB對一系列的底物進行磷酸化,從而對細胞產生各種各樣的效應。
通過Ras同源物Ral進行的調控
Ras下游三大效應通路中的第三條通路涉及一對Ras樣蛋白:RalA和RalB,這兩種蛋白質與Ras具有58%的序列同源性。同Ras一樣,Ral蛋白的功能激活依賴于GTP取代GDP與之相結合。
Ras和Ral之間的信號轉導由Ral鳥嘌呤核苷酸交換因子(Ral-GEF)介導,Ral-GEF能促進Ral蛋白釋放GDP并結合GTP,這與Sos對Ras蛋白的作用類似。除了它的GEF結構域,每個Ral-GEF還有一個能結合活性狀態下Ras的口袋形結構域。Ral-GEF與Ras的結合,使Ral-GEF定位在細胞膜的內表面,而且能引起Ral-GEF構象改變,激活其內在的GEF的活性。RalA和RalB蛋白被激活后,進一步調節信號通路的下游靶基因。
Jak-STAT信號通路
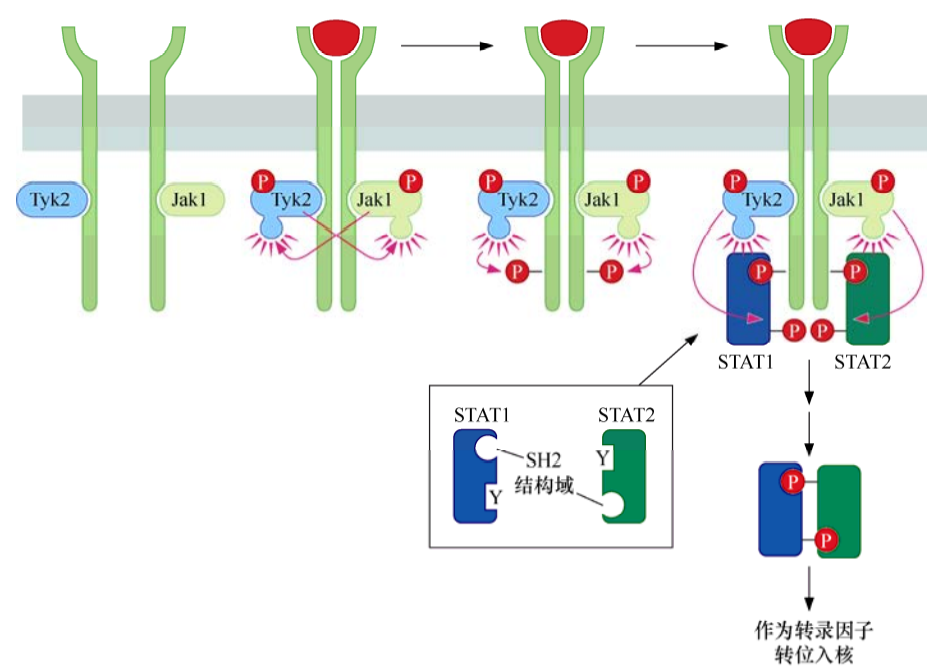
造血系統刺激因子受體與大多數生長因子受體略有不同,它們沒有共價結合的酪氨酸激酶結構域,而是與Jak(Janus激酶)一類的酪氨酸激酶形成非共價復合物。
由配體結合介導受體發生二聚化后,每個受體分子結合的Jak酶將二聚體中另一個受體分子的細胞質尾部酪氨酸磷酸化,形成的磷酸化酪氨酸吸引并結合含有SH2結構域的轉錄因子STAT(信號轉導和轉錄激活蛋白)。這些STAT進一步被Jak磷酸化后形成同時含有SH2結構域和磷酸化酪氨酸的單個STAT分子。重要的是,STAT的SH2結構域能夠特異性地結合STAT上形成的磷酸化酪氨酸殘基,因此形成STAT-STAT二聚體,其中每個STAT都通過其SH2結構域與二聚體中另一STAT的磷酸化酪氨酸相結合。形成的STAT二聚體遷移入核,作為轉錄因子發揮功能。? ? ?
? ?
STAT可以激活對細胞增殖和細胞存活及其重要的靶基因,包括如myc、cyclinD2和D3,以及編碼強抗凋亡蛋白Bcl-XL的基因等。
有關STAT促進癌癥發生發展最生動的例子來自STAT3,在STAT3中插入一對半胱氨酸殘基,突變后的STAT3能夠自發二聚化并形成共價二硫鍵從而穩定地交聯。這樣形成的STAT3突變二聚體作為核內轉錄因子的作用使組成性激活的,因此具有致癌蛋白功能。
其它信號通路
整合素信號轉導
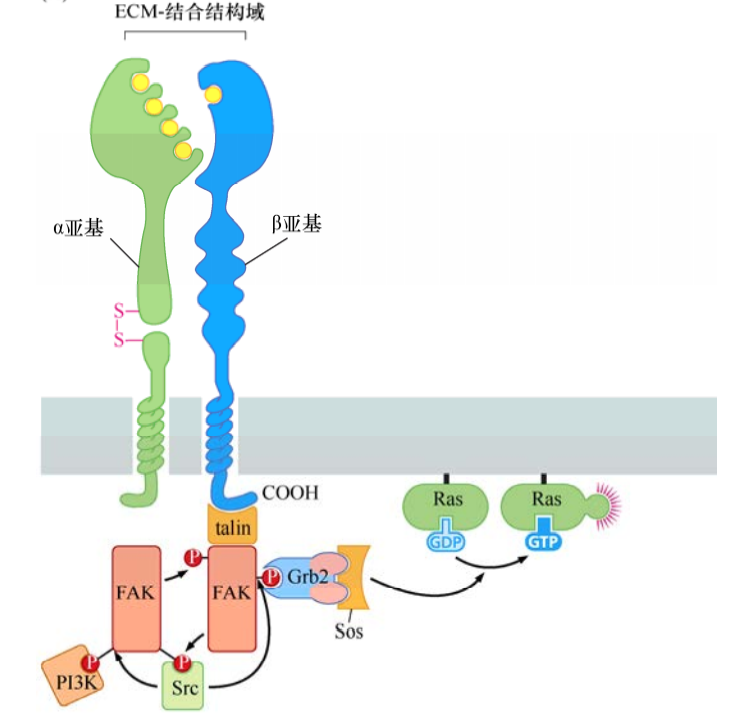
整合素由α+β二聚體組成。除了把細胞骨架與細胞外基質連在一起,整合素二聚體的胞外功能區與細胞外基質的結合引發一系列細胞內信號轉導蛋白的結合(如黏著斑激酶FAK),結合到β亞基的胞內結構域。由此導致反式磷酸化作用及結合的含SH2結構域信號分子釋放出信號,激活配體激活的生長因子受體信號通路。
? ? ? ? ? ? ? ? ? ? ? ?
? ?
Wnt-β-catenin通路
如同許多整合素一樣,鈣黏蛋白是一種跨膜蛋白,與細胞外空間有聯系,經中介蛋白與肌動蛋白細胞骨架相連。破壞這種黏附連接會引起腫瘤細胞的高度惡性表型。
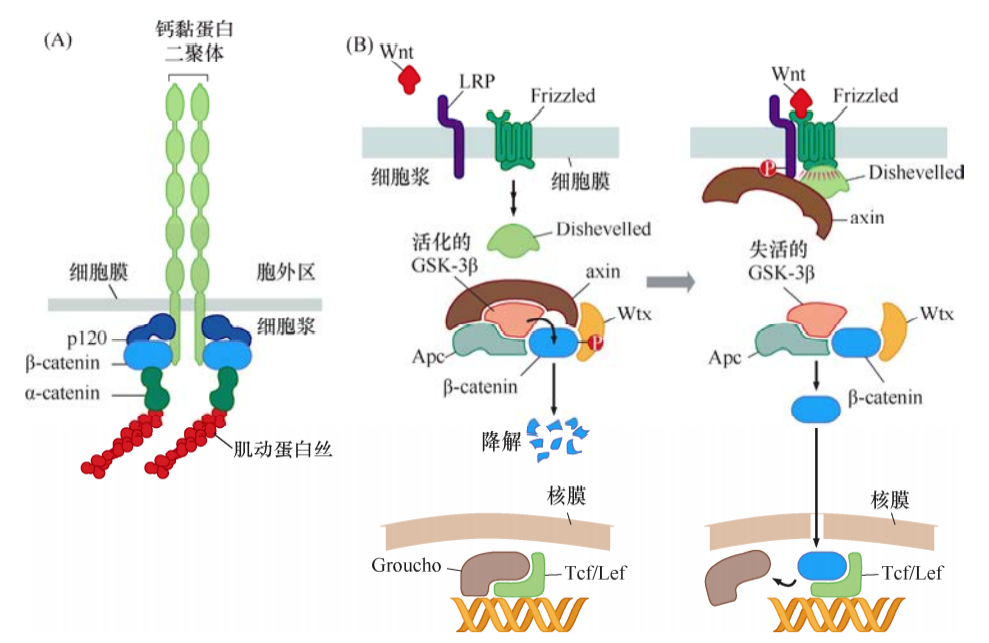
Wnt蛋白通過結合到其Frizzled受體及LRP受體,經Dishevelled作用,抑制GSK-3β的活性,阻止GSK-3β磷酸化包括β-catenin在內的底物。逃脫降解的β-catenin在胞質和胞核里累積,而且一入核,β-catenin便會結合Tcf/Lef蛋白,激活轉錄。β-catenin和Tcf/Lef形成的轉錄因子復合物能激活多個重要靶基因,包括那些編碼細胞生長增殖相關蛋白的基因,如cyclinD1和Myc。
G蛋白偶聯受體
G蛋白偶聯受體是一種7次跨膜受體蛋白,可以活化多種異源三聚體G蛋白,它們最大的區別在于Gα亞基。一旦被GPCR所激活,Gα亞基從Gβ和Gγ脫離,進而激活或者抑制胞漿中的酶類。這些酶類再根據細胞類型不同而依次產生促細胞分裂或者抑制細胞分裂的作用。同時,Gβ+Gγ二聚體也可以活化它們下游的效應蛋白,包括磷脂酰肌醇3-激酶γ(PI3Kγ)、磷脂酶C-β(PLC-β)和Src。
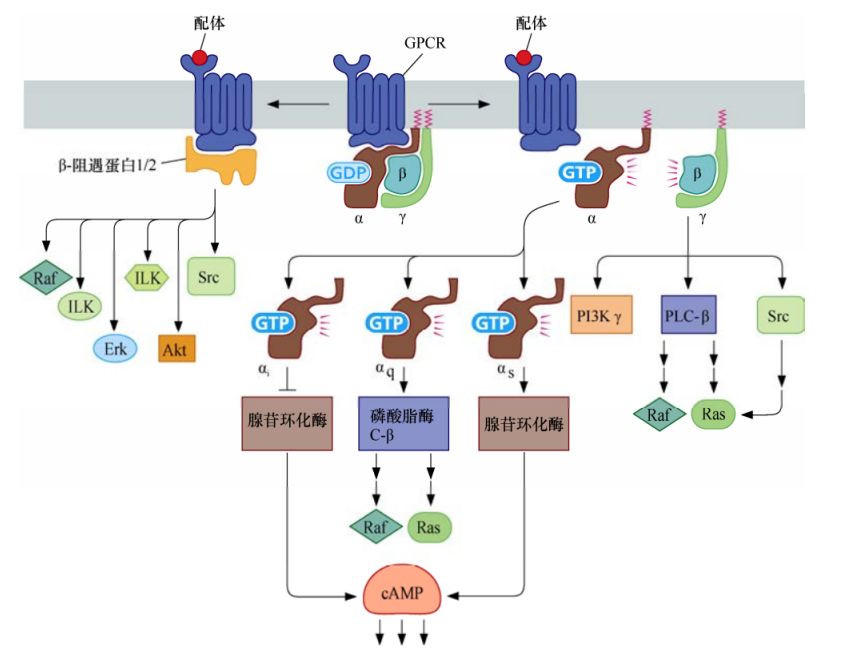
GPCR活化后,另一組受體相關蛋白β-arrestin1和β-arrestin2也開始活化一系列已知在細胞增殖和存活過程中發揮關鍵作用的激酶。
NF-κB信號通路
人們發現在一類快速轉化的火雞逆轉錄病毒中的癌基因rel,在B細胞淋巴瘤網狀內皮組織增生形成中發揮重要作用。后來在研究調控免疫球蛋白表達的轉錄因子時發現Rel屬于某一類轉錄因子家族,后命名為NF-κB。這些蛋白質在細胞質中形成同源和異源二聚體。
最常見的NF-κB異源二聚體由p65和p50組成。通常NF-κB被另一個多肽-IκB(NF-κB抑制因子)阻滯在細胞質中。在這種狀態下,這個信號系統保持沉默。但是,在接收到某些不同來源的信號時,IκB被磷酸化并迅速降解。結果,NF-κB從IκB的禁錮中解放出來,并移動到細胞核中,進而激活一大批基因,其中包括抗凋亡和促進細胞分裂的基因。
Notch信號通路
這條通路由Notch蛋白調控。關于這條通路的研究可以追溯到1919年,那時人們發現了果蠅的一個等位基因可以引起果蠅翅膀邊緣形成凹口(notch)。幾十年后,人們又發現了Notch是一個跨膜蛋白。
Notch是一個細胞表明受體,當與配體(Jagged或Delta-like蛋白)結合后經歷兩次蛋白酶切,一次在細胞外結構域,另一次在細胞跨膜區。后一次的酶切從細胞膜附著處釋放出一個大的胞質蛋白片段,這個片段隨后移動到細胞核中,與其伴侶蛋白一起作為轉錄因子發揮作用。
Hedgehog信號通路
當Patched受體與其配體Hedgehog結合時,改變了Patched(Ptc)與Smo的相互作用,結果導致Smoothened與Gli在初級纖毛富集,位置主要在纖毛頂部。
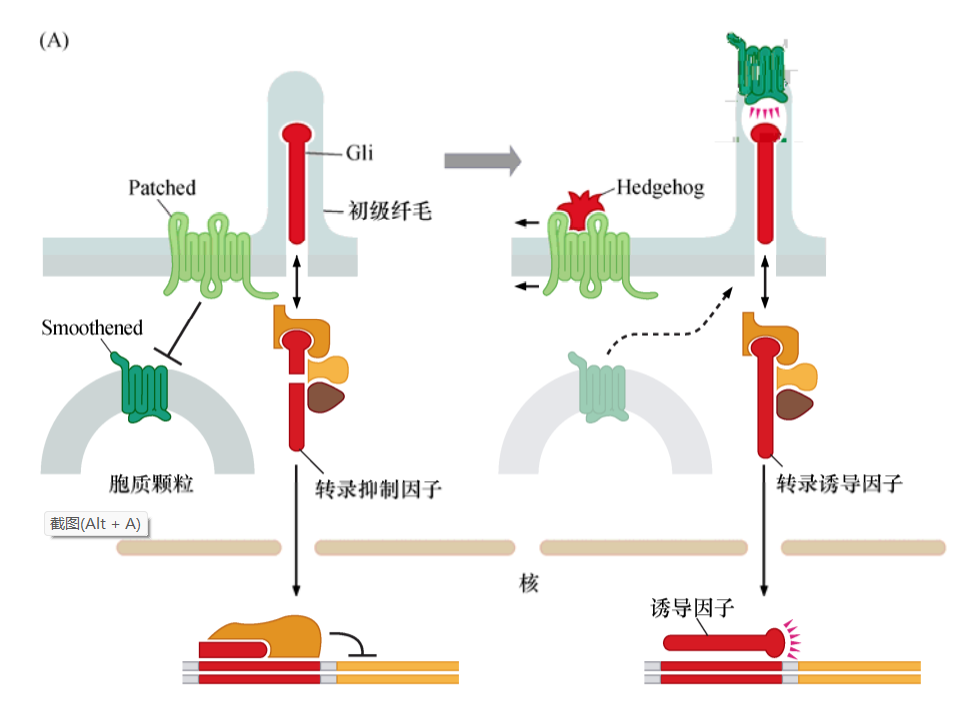
正常狀態下,在缺少Smoothened蛋白調節時,Gli前體蛋白被切割為兩個片段,其中一段移動到細胞核中,在那里行使轉錄抑制因子的功能。但是,當Smoothened被活化shi時,Smoothened與Gli在初級纖毛相互作用,Gli前體的切割被抑制,導致完整的Gli蛋白移動到細胞核中,作為轉錄激活因子發揮功能。
TGF-β信號通路
TGF-β和它所引起的信號轉導通路幾乎在所以的腫瘤發生中起重要作用,包括腫瘤發生早期TGF-β在多種類型細胞中阻滯細胞生長及在隨后的腫瘤進展期影響腫瘤侵襲的表型。
TGF-β結合到II型TGF-β受體,將I型和II型TGF-β受體結合在一起,導致I型受體磷酸化而活化。活化的I型受體磷酸化細胞質中的Smad2或Smad3蛋白,磷酸化的Smad與Smad4結合。最后這種異源二聚體的Smad復合物(由Smad2/2/4、2/3/4或者3/3/4組成)轉位到細胞核中,在那里與相鄰的轉錄因子共同作用,驅動或抑制基因的表達。
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lcyj/23562.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃