伊利諾伊大學(xué)芝加哥分校牙科學(xué)院的Lyndon F. Cooper等,在Front. Physiol.發(fā)表了題為A Role for Exosomes in Craniofacial Tissue Engineering and Regeneration(外泌體在顱面組織工程和再生中的作用)的研究成果,總結(jié)了 MSC 外泌體在控制或誘導(dǎo)骨、軟骨、牙本質(zhì)、黏膜和牙髓組織形成中的應(yīng)用。外泌體的下一步工程為增強(qiáng)口腔和顱面組織工程和再生提供了額外的途徑。
?
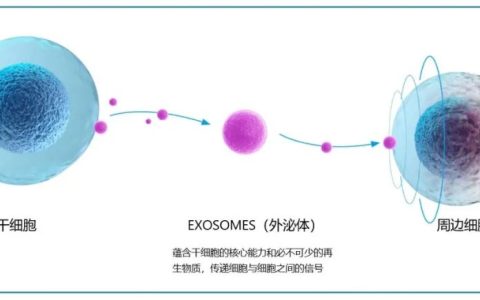
組織工程和再生醫(yī)學(xué)利用間充質(zhì)干細(xì)胞 (MSCs) 及其分泌組來(lái)創(chuàng)造或誘導(dǎo)功能性組織替代。外泌體是由 MSC 和其他細(xì)胞分泌的特定細(xì)胞外囊泡 (EV),它們將信息貨物從 MSC 運(yùn)送到影響基本細(xì)胞過(guò)程的靶細(xì)胞,包括細(xì)胞凋亡、增殖、遷移和譜系特異性分化。
顱面組織的重建包括廣泛的生物和臨床興趣。特定的生物或臨床關(guān)切是否涉及骨,軟骨,唾液腺,皮膚和粘膜,肌肉或神經(jīng),分享組織再生的基本原則和挑戰(zhàn)。
針對(duì)組織再生的組織工程力涉及三個(gè)關(guān)鍵要素,支架,生長(zhǎng)因子和細(xì)胞單獨(dú)使用或一起使用以替代功能組織。關(guān)于組織工程的細(xì)胞成分,間充質(zhì)干細(xì)胞(MSCs)一直是顱面再生的許多努力的重點(diǎn)。MSCS廣泛可從各種組織中獲得,并且能夠擴(kuò)展(有限的自我更新)和多譜系分化成骨,軟骨,脂肪,肌肉和神經(jīng)。
同種異體細(xì)胞的使用需要強(qiáng)烈篩選來(lái)排除疾病傳播。然而,與胚胎干細(xì)胞或誘導(dǎo)的多能干細(xì)胞的使用不同,MSCs不會(huì)導(dǎo)致移植后畸胎瘤形成的相同風(fēng)險(xiǎn),或者與ESC USEN相關(guān)的相同道德問(wèn)題。
間充質(zhì)干細(xì)胞可在移植后以幾種方式起作用。移植的MSCs可以植入并分化為直接形成新組織,它們可以通過(guò)帕瓜堿信號(hào)傳導(dǎo)來(lái)介導(dǎo)新組織的宿主細(xì)胞形成,以誘導(dǎo)分化細(xì)胞以直接組織再生和血管生成,或者它們可以通過(guò)涉及直接細(xì)胞的免疫調(diào)節(jié)調(diào)節(jié)來(lái)控制傷口愈合和再生,到細(xì)胞或間接分泌信號(hào)。
免疫調(diào)節(jié)被認(rèn)為是傷口愈合中MSC功能的重要方面,因此是組織工程。這些機(jī)制可能不是相互排斥的,重要的是,本地提示可能影響組織再生中MSC的組織特異性/譜系特異性功能。然而,通過(guò)影響宿主干細(xì)胞保護(hù),細(xì)胞凋亡,新血管化和招生和分化來(lái)深入地影響基于MSC的組織工程的成功。這強(qiáng)調(diào)了植入的MSCS作為持續(xù)釋放因素的源于局部條件的源泉的優(yōu)勢(shì)。
口腔和顱面組織工程中的MSC外來(lái)作用
可以分離由來(lái)自口腔組織的MSCs收獲的外泌體,并用于顱面組織工程。來(lái)自不同組織的外泌體也可用于促進(jìn)顱面修復(fù)和再生。對(duì)顱面和口腔組織再生的外泌體的潛在用途包括骨組織工程。
MSC外來(lái)物用于增強(qiáng)小鼠中的骨折愈合。重要的是,當(dāng)用外泌體處理顯示減少外出生成和顯示延遲愈傷組織的CD9 ?,展示延遲愈傷組織的小鼠時(shí),加速了CD9小鼠骨折愈合。研究表明,MIRNA調(diào)節(jié)骨細(xì)胞分化。包括WNT途徑和PI3K / AKT途徑的特異性途徑可能受MSC外泌體的影響。
MSC外來(lái)體在免疫調(diào)節(jié)中的作用
間充質(zhì)干細(xì)胞廣泛分布于組織中,在組織修復(fù)和再生過(guò)程中似乎與局部炎癥微環(huán)境相通。MSCs 在修復(fù)和再生過(guò)程中參與炎癥細(xì)胞的募集和調(diào)節(jié)。損傷后,已知募集的 MSC 會(huì)產(chǎn)生免疫調(diào)節(jié)因子,從而促進(jìn)炎癥和傷口愈合的進(jìn)展。
已知 MSC 分泌組包含許多指導(dǎo)血管生成、細(xì)胞外基質(zhì)合成和重塑以及祖細(xì)胞分化的生長(zhǎng)因子和細(xì)胞因子。在免疫調(diào)節(jié)方面,間充質(zhì)干細(xì)胞通過(guò)與免疫細(xì)胞直接接觸而發(fā)揮作用,它們分泌有效因子,包括 TGF-β、NO、PGE2、1L-17 和 IL-10。間充質(zhì)干細(xì)胞通過(guò)交流改變 TC、樹(shù)突狀細(xì)胞、B 細(xì)胞和 NK 細(xì)胞的活性,從而在修復(fù)過(guò)程中調(diào)節(jié)炎癥。
從牙齒組織中分離外泌體
外泌體可以從牙齒組織的 MSC 中分離出來(lái)。剝落乳牙或有意采集的成年牙齒都可以提供用于再生目的的牙髓干細(xì)胞 (DPSC) 。DPSCs 通過(guò)體內(nèi)多能分化直接再生,包括肝臟、牙髓、骨骼、肌肉和神經(jīng),此外還促進(jìn)再生組織的血管化。
神經(jīng)嵴衍生的 DPSC 可能在神經(jīng)再生中提供特別有價(jià)值的功能,如其表型、它們沿神經(jīng)源性譜系的分化和功能研究證明 DPSC 介導(dǎo)的坐骨神經(jīng)功能再生。DPSCs 的一個(gè)主要限制是在再生醫(yī)學(xué)中獲得的自體使用的細(xì)胞數(shù)量相對(duì)較少,但它們被提倡作為組織/細(xì)胞庫(kù)的合適 MSC。DPSC 與骨髓來(lái)源的 MSC 相比的主要優(yōu)勢(shì)是相對(duì)可用性和易于訪(fǎng)問(wèn)(提取/牙髓治療)。
我們探索 DPSC 外泌體的努力可能為使用培養(yǎng)擴(kuò)增或永生化 DPSC 的再生提供同種異體資源。鑒于外泌體的長(zhǎng)期穩(wěn)定性,外泌體可能在再生醫(yī)學(xué)中發(fā)揮重要作用。研究中證實(shí),DPSC 外泌體,如 MSC 外泌體,可促進(jìn)靶細(xì)胞和組織中的免疫保護(hù)和抗凋亡機(jī)制,更具體地說(shuō),DPSC 外泌體表現(xiàn)出紙漿再生潛力。
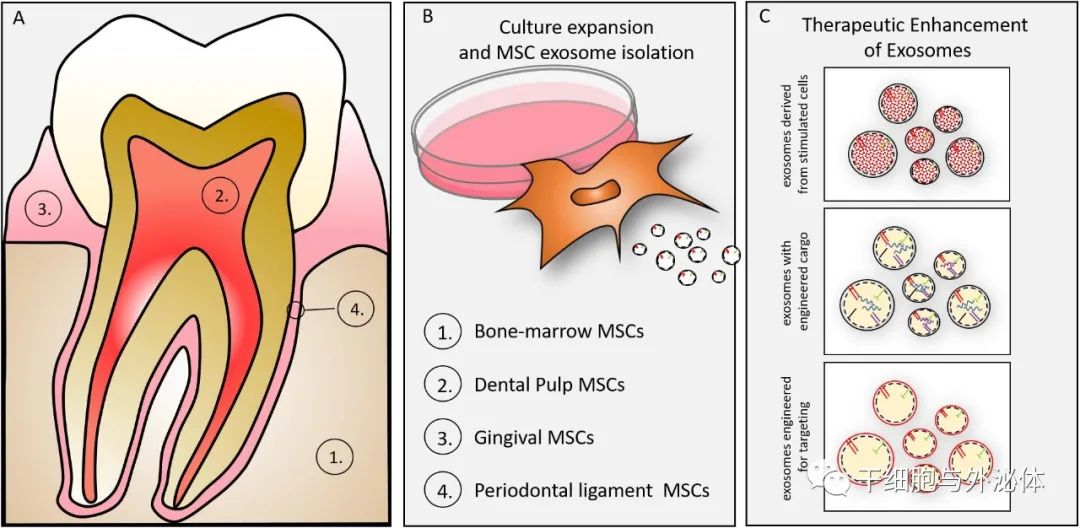
用于治療的外泌體
外泌體的先天特征表明其在臨床治療中的創(chuàng)新用途。它們的納米級(jí)尺寸、與快速內(nèi)吞作用相關(guān)的膜組成、相對(duì)缺乏毒性、穩(wěn)定性和進(jìn)入中樞神經(jīng)系統(tǒng)(通過(guò)血腦屏障)結(jié)合起來(lái)為向靶細(xì)胞傳遞特定信號(hào)提供了一種載體。
這些信號(hào)(蛋白質(zhì)、RNA、miRNA)代表了親代細(xì)胞的譜系和生理。外泌體還可能具有同種異體性,可以使用特征良好且標(biāo)準(zhǔn)化的供體來(lái)源。此外,本綜述反復(fù)引用了使用人類(lèi) MSC 外泌體在動(dòng)物研究中取得積極成果的異種移植成功。
此外,可以設(shè)計(jì)外泌體以攜帶特定的貨物和合成(藥物)貨物以用于治療目的。親代細(xì)胞的刺激或基因操作可以改變外泌體貨物以增強(qiáng)再生。或者,可以通過(guò)電穿孔、基于化學(xué)的轉(zhuǎn)染、簡(jiǎn)單的孵育方法將選定的 siRNA、miRNA、藥物和酶直接加載到外泌體中。早期研究還表明,外泌體可能通過(guò)凍干保存更長(zhǎng)時(shí)間。外泌體的進(jìn)一步工程化可能涉及表面蛋白的表達(dá),以將外泌體引導(dǎo)至特定的細(xì)胞外基質(zhì)或選定的細(xì)胞。
口腔和全身疾病診斷中的外表作用
唾液外泌體在診斷系統(tǒng)和口服疾病方面的作用是目前醫(yī)學(xué)和牙科外來(lái)運(yùn)動(dòng)的推測(cè)應(yīng)用的一個(gè)例子。唾液在口腔和全身疾病診斷中的重要性是日益增長(zhǎng)的興趣。該領(lǐng)域擴(kuò)大以使用液體活檢(非侵襲性生物流體試驗(yàn))進(jìn)行蛋白質(zhì)組學(xué),轉(zhuǎn)錄組,微生物學(xué),代謝組和微稻草分析。雖然不是本評(píng)論的預(yù)期焦點(diǎn),但外表在疾病的診斷中使用對(duì)醫(yī)學(xué)和牙科的興趣越來(lái)越令人興趣,并在此處進(jìn)行簡(jiǎn)要考慮。
從生物流體中分離的外泌體可以克服局限性,例如相對(duì)低表達(dá)生物標(biāo)志物和全部和腺唾液中的RNA和miRNA的降解。外泌體可以使用市售的套件,超速離心方法和專(zhuān)用的兩相體系分離,以改善唾液外出分離。顯示出從腺唾液中分離的外泌體具有唾液腺疾病狀態(tài)獨(dú)特的miRNA。最近審查了使用唾液外泌體作為癌癥的生物標(biāo)志物。FTIR的表征由FTIR的患有健康個(gè)體口腔癌受試者的外泌體,并提出了早期階段口腔癌的未來(lái)診斷的非侵入性方法。
編輯:小果果,轉(zhuǎn)載請(qǐng)注明出處:http://www.448371.com/cells/wmt/8593.html
免責(zé)聲明:本站所轉(zhuǎn)載文章來(lái)源于其他平臺(tái),主要目的在于分享行業(yè)相關(guān)知識(shí),傳遞當(dāng)前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請(qǐng)及時(shí)告知,我們會(huì)在24小時(shí)內(nèi)刪除相關(guān)信息。
說(shuō)明:本站所發(fā)布的案例均摘錄于文獻(xiàn),僅用于科普干細(xì)胞與再生醫(yī)學(xué)相關(guān)知識(shí),不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃