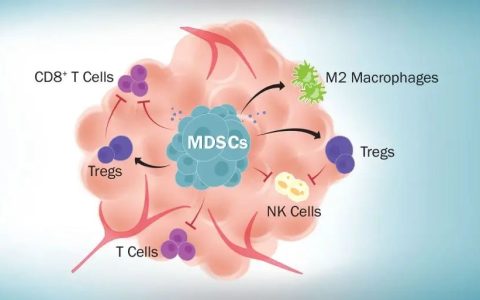
而,CD19 CAR-T治療的成功并不是沒有副作用的。CD19 CAR-T細胞根除腫瘤導(dǎo)致多種炎癥細胞因子的釋放,包括IL-6和TNF-α,這被稱為細胞因子釋放綜合征(CRS)。因此將CAR-T治療從b細胞惡性腫瘤轉(zhuǎn)化為其他腫瘤(包括其他血液惡性腫瘤)仍然面臨著幾個需要解決的障礙:
1.特異性
2.耐藥性/逃逸
3.實體腫瘤
4.制造
?
與T細胞類似,NK細胞被表面表達CAR來靶向特定抗原,特異性增強其自然細胞毒性。
表1:
|
|
CAR-T |
捐獻的CAR-NK |
PSC-CAR-NK |
|
細胞來源 |
自體外周血 |
同種異體血和臍帶血 |
異源性iPSC和hESC胞,無限的 |
|
生產(chǎn)時間、成本和可提供的劑量 |
耗時,成本高,單次劑量 |
現(xiàn)成的,低成本的,有限的多種劑量 |
現(xiàn)成的,非常低的成本,對所有病人的無限劑量的劑量 |
|
產(chǎn)品特性 |
異質(zhì) |
異質(zhì) |
同質(zhì) |
|
基因編輯/CAR |
隨機和可變 |
隨機的和可變的,大量的細胞因病毒感染而死亡 |
統(tǒng)一,PSCs中的CAR/基因編輯-100%的CAR/基因編輯的NK細胞 |
|
癌癥干細胞 |
沒有優(yōu)先目標(biāo) |
是的,優(yōu)先瞄準(zhǔn) |
是的,優(yōu)先瞄準(zhǔn) |
|
殺傷機制 |
car介導(dǎo)的細胞殺傷 |
CAR和NK受體介導(dǎo)的細胞殺傷 |
CAR和NK受體介導(dǎo)的細胞殺傷,以及基因編輯 |
|
安全性:CRS |
高 |
低 |
低 |
|
GvHD |
高,具有同種異體細胞 |
低的,甚至有同種異體細胞 |
低的,甚至有同種異體細胞 |
|
主細胞庫 |
無 |
無 |
是的:用于各種目標(biāo)的PSC-CAR細胞庫 |
?
在分化的PSC培養(yǎng)中,已發(fā)現(xiàn)造血前體以及成熟的紅系、髓系、巨噬細胞、巨核細胞和淋巴系。PSC-NK細胞能夠在細胞因子刺激下分泌IFNγ,并對多種類型的癌細胞具有強大的自然細胞毒性,并在異種移植小鼠模型中顯示出抗腫瘤活性。與PB-NK細胞相比,一些細胞組也成功地將PSC分化為表型相似的NK細胞,如NK相關(guān)受體表型和效應(yīng)功能。
PSC為NK細胞等基因工程細胞產(chǎn)物的生成提供了一個全新的途徑。與基于供體的CAR-NK細胞相比,PSC-CAR-NK有幾個優(yōu)勢(表1)
?
我們開發(fā)了一種新的3d生物反應(yīng)器平臺,可以有效地將人PSCs在單一生物反應(yīng)器中連續(xù)轉(zhuǎn)化為高純度的NK細胞(圖1)。這種分化系統(tǒng)使用明確的無血清培養(yǎng)基,并消除了任何飼養(yǎng)細胞的使用。首先,人類造血干細胞從2D單層培養(yǎng)適應(yīng)于3D球體,并在生物反應(yīng)器中擴大,然后3D造血干細胞球體被誘導(dǎo)為中胚層系分化,將60-70%的造血干細胞轉(zhuǎn)化為血細胞。60-70%的PSCs變成了造血內(nèi)皮細胞祖細胞(CD31+ CD144+ CD34+)。然后將造血內(nèi)皮細胞轉(zhuǎn)換到造血和NK細胞分化條件下,持續(xù)長達35-45天。從大約第15天開始,NK細胞從這些3D球中釋放出來,并持續(xù)4周,并通過簡單的離心收集釋放出來的NK細胞(圖1)。釋放的PSC-NK細胞表現(xiàn)出明顯的同質(zhì)形態(tài),并表達了典型NK細胞特有的基因特征。收集到的細胞中超過95%表達CD56,并激活NKG2D、NKp44和NKp46的受體(圖2)。這些CD56+ PSC-NK細胞不表達TCR和CD3的T細胞標(biāo)記,也不表達B細胞標(biāo)記CD19;而超過60%的CD56+ PSC-NK細胞也表達CD8α(圖2),而PB CD56+NK細胞的表達率為30%,NK細胞的增加與艾滋病患者的疾病消退有關(guān)。我們用300毫升的生物反應(yīng)器可重復(fù)生成1010個純NK 細胞,并且這個過程已經(jīng)在多個具有/不具有基因編輯或CAR的hESC和iPSC系中重復(fù)進行。
體外實驗表明,生物反應(yīng)器產(chǎn)生的PSC-NK細胞能夠分泌IFNγ,表達CD107a(脫顆粒),并對白血病細胞、胰腺癌、卵巢癌、結(jié)直腸癌和肺癌等多種腫瘤細胞表現(xiàn)出強大的天然細胞毒性。我們還證明了PSC-NK細胞具有抗病毒活性,并特異性地殺死感染甲型流感、登革熱、寨卡病毒和HIV病毒的正常細胞,但不殺死未感染的正常細胞。該3D PSC-NK制造平臺使用定義的材料,不含血清或飼養(yǎng)細胞,可擴展和可重復(fù)用于生成同質(zhì)功能NK細胞。隨著永久主PSC-CAR細胞系的建立,這種新型技術(shù)平臺將為產(chǎn)生適合大量患者治療的現(xiàn)成CAR-NK細胞提供取之不盡的細胞來源,從而使細胞免疫治療領(lǐng)域發(fā)生革命性的變化。
? ? ? ? ?
?

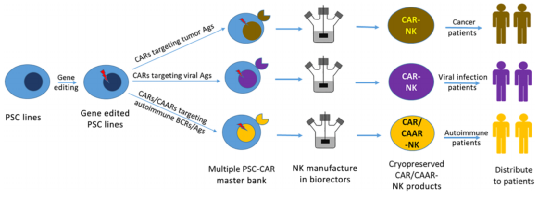
從PSCs衍生的細胞產(chǎn)品的成功臨床應(yīng)用將需要PSCs向特定的細胞類型進行有效和可控的分化,并產(chǎn)生一個同質(zhì)的細胞群。我們的3D PSC-NK技術(shù)提供了一個可擴展的、一致的、高效的和具有成本效益的制造平臺,以產(chǎn)生同質(zhì)的功能性NK細胞。如圖3所示,GMP級PSC系可在多能階段進行基因操縱,以增強最終NK細胞產(chǎn)品的持久性和細胞毒性。基因編輯的PSC系可以進一步設(shè)計出針對不同癌癥抗原和病毒抗原或自體活性T細胞的CAR,以及針對自體活性B細胞的嵌合自體抗體受體(CAAR)。建立多個針對不同特定抗原的主PSC-CAR細胞庫,將為制造真正異源的現(xiàn)成CAR-NK細胞提供取之不盡的細胞來源,可以在全球范圍內(nèi)迅速部署到癌癥、感染和自身免疫性疾病患者。
?
?
?
?
編輯:小果果,轉(zhuǎn)載請注明出處:http://www.448371.com/cells/myxb/33049.html
免責(zé)聲明:本站所轉(zhuǎn)載文章來源于其他平臺,主要目的在于分享行業(yè)相關(guān)知識,傳遞當(dāng)前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請及時告知,我們會在24小時內(nèi)刪除相關(guān)信息。
說明:本站所發(fā)布的案例均摘錄于文獻,僅用于科普干細胞與再生醫(yī)學(xué)相關(guān)知識,不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃