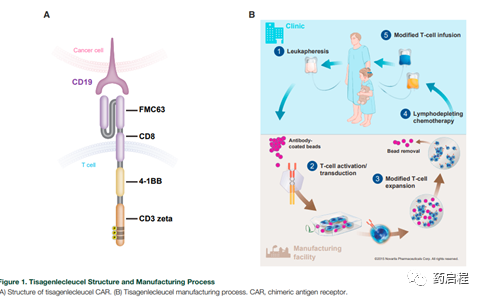
介紹
癌細胞逃避免疫系統的主要機制之一是通過下調和丟失其主要組織相容性復合物I類 (MHC-I) 分子(又名人類白細胞抗原 (HLA))。通常,MHC-I陽性腫瘤細胞會被具有識別MHC I類分子展示的腫瘤特異性肽的T細胞受體(TCR)的T細胞靶向。TCRs對癌細胞表面載肽MHCs (pMHCs)的識別和結合導致T細胞和癌細胞之間形成溶細胞性突觸,導致細胞毒性蛋白,如穿孔素和顆粒酶的定向大量釋放,以及克隆T細胞的活化和增殖。
在這種和其他突觸相互作用中T細胞的最佳激活需要兩個信號,TCR-MHC相互作用,稱為“信號 1”和通過T細胞上的幾種共刺激受體之一的共刺激信號(“信號 2”)(例如CD28、CD137、OX40、CD27、ICOS、GITR)及其同源配體(例如,CD80/86、CD137L、OX40L、CD70、ICOS-L、GITR-L)在靶細胞或專職抗原呈遞細胞(APC) 。
第三個信號,免疫刺激細胞因子的產生,有助于驅動T細胞分化和擴增。基于MHC-I損失的腫瘤逃逸機制進一步復雜化,因為腫瘤細胞特異性新抗原通常是“最小的”或難以區分,因為它們可能只是與其野生型等位基因不同的單個殘基,低MHC-I復合物的親和力或表現不佳。
MHC-I分子的丟失或下調以及癌細胞中強腫瘤抗原的缺失使這些細胞能夠逃脫腫瘤浸潤性T細胞的識別和殺傷,而腫瘤浸潤性T細胞是抗腫瘤免疫反應的關鍵組成部分。
此外,共刺激分子(例如,CD86、CD54)的丟失、檢查點抑制分子(例如,PD-1、CTLA4)的過量產生以及色氨酸降解酶吲哚胺2,3-雙加氧酶的腫瘤產生(IDO),它消除了色氨酸,色氨酸是T細胞增殖所需的一種關鍵氨基酸,是腫瘤利用機制逃避細胞毒性T細胞的其他例子。
今天,各種治療策略試圖以獨立于TCR功能的方式利用T細胞的殺傷力,繞過HLA限制性抗原識別的限制。目前采用的兩種最重要的基于TCR功能的T細胞治療策略是T細胞重定向雙特異性抗體(TRBA)和嵌合抗原受體(CAR)-T細胞。
對于TRBA,分化簇 3(CD3)的ε(ε)結構域是TCR復合物的一個組成部分,它被一個結合(即結合)結構域靶向,而第二個結合結構域(因此,“雙特異性”抗體)結合腫瘤細胞表面抗原(圖 1B)。這些TRBA的作用是使T細胞和靶細胞靠近以形成溶細胞性突觸,從而導致腫瘤細胞死亡。在嵌合抗原受體(CAR)-T細胞的情況下,與T細胞激活細胞內結構域融合的癌細胞表面抗原靶向抗體片段在T細胞表面表達為新受體(圖1D)。然后,這些識別腫瘤抗原的“武裝”T細胞將識別、結合并殺死目標癌細胞。這兩種策略都依賴于抗體來取代TCR的功能,使其獨立于TCR及其同源MHC-I/肽識別,并且都可以用于識別和靶向MHC-I 領域之外的腫瘤特異性抗原–展示的新抗原肽。
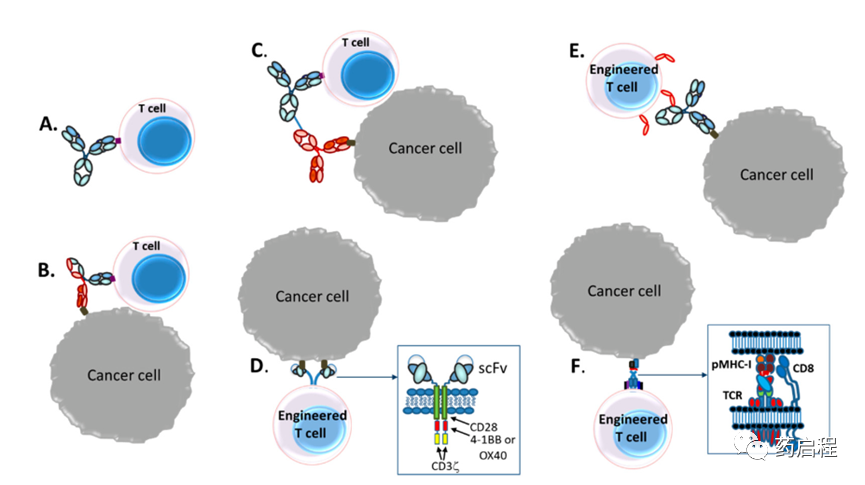
圖 1. 臨床開發中基于T細胞的療法的示例。 (A)抑制PD-1和CTLA-4等檢查點受體以提高T細胞活性[18]; (B)雙特異性抗體(TRBA)的T細胞重定向,其中一個結合臂識別腫瘤抗原,另一個結合臂識別T細胞上的CD3ε;(C)自體T細胞離體激活,結合雙特異性抗體偶聯物識別腫瘤抗原與一種mAb和T細胞上的CD3ε與另一種mAb,然后重新給藥于患者以殺死腫瘤;(D)基因工程自體嵌合抗原受體(CAR)-T細胞,其中抗體,通常是單鏈可變片段(scFv),與CD28、4-1BB、OX40 和CD3ζ等細胞內T細胞激活結構域融合,取代T 細胞受體(TCR)的功能,使T細胞成為特定抗原承載細胞的殺手;(E)用FcγRIIIa (CD16a)基因工程改造的自體或同種異體T細胞或NK細胞,當與抗腫瘤單克隆抗體(mAb)如抗CD20單克隆抗體利妥昔單抗一起給藥時,它們與抗體并在功能上將T或NK細胞重定向到腫瘤以殺死癌細胞;(F)具有工程化TCR的自體T細胞。
兩種形式的治療方法,即通過TRBA重定向T細胞以殺死腫瘤細胞和從患者T細胞中產生自體CAR-T細胞,在今天作為下一代抗腫瘤生物療法提供了巨大的希望。這些方法也被用作潛在的抗病毒療法。
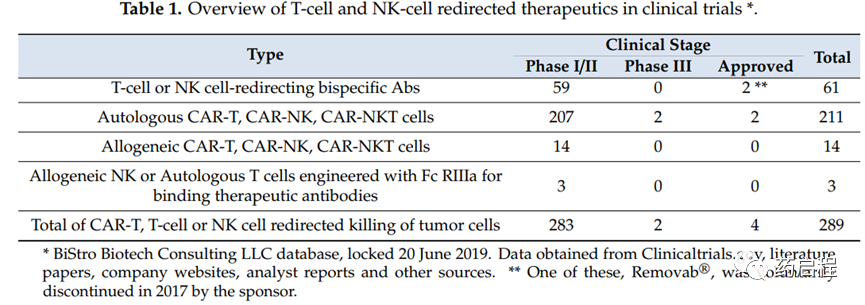
截至2019年6月20日,兩種基于T細胞的方法已獲得主要監管機構的批準。總之,至少有289種獨特的T/NK細胞重定向治療候選藥物,包括61種不同的TRBA、225種獨特的CAR-T和三種用CD16a轉導的T/NK細胞,目前正在超過320項獨特的臨床試驗中進行測試(表1)。此外,利用基于這兩種主要T細胞治療策略的概念的其他治療方法也在臨床試驗中進行測試(圖1)。目前批準的數量已遠遠超過這個數量。
1. T細胞重定向雙特異性抗體簡史
1970 年代中期的兩項基本發現最終導致了基于TCR功能的治療方法的概念治療至少某些形式的癌癥的最有希望的范例。其中第一個是著名的諾貝爾獎獲得者,K?hler和Milstein發現了從雜交瘤中制備和表征單克隆抗體的方法。第二個是基本觀察,活化的細胞毒性T淋巴細胞(CTL)可以作為靶向癌細胞的連環殺手 ,通過與靶細胞形成免疫突觸,然后脫粒和釋放溶細胞穿孔素和顆粒酶等蛋白質。這些和其他早期研究最終導致了TRBA的發展,以接合和重定向T細胞以誘導抗原特異性靶向癌細胞的連續殺傷以及自體T 胞的基因工程以賦予它們癌癥能力細胞表面抗原特異性靶向抗體受體(即 CAR)與T細胞激活結構域融合。
在最初從免疫小鼠中分離出單克隆抗體(mAb)的十年內,第一個雙特異性抗體是使用多種方法產生的,包括雜交雜交瘤、兩種全長IgG的化學綴合和Fabs ,使用硫氫鍵的還原和氧化過程形成雙特異性 F(ab’)2抗體以及基于單鏈變量制造雙特異性抗體片段的重組方法片段(scFvs)。
今天,在T細胞重定向雙特異性抗體和CAR-T細胞的海嘯中,或許沒有得到充分的重視,這是第一個通過將一個抗體重組(或結合)位點與 T 細胞表面標志物結合以殺死被結合的腫瘤細胞來重定向T細胞的概念和實踐。其他重組位點在1985-1986年的幾篇論文中進行了闡述。此后不久,即1987年,首次描述了使用TCR的 CD3成分作為T細胞靶標進行重定向。
圖 2 列出了T細胞重定向雙特異性抗體和CAR-T療法的簡史。1990年代的幾項關鍵進展為今天用于臨床階段候選抗體的多種T細胞重定向雙特異性抗體形式奠定了基礎。第一次給藥T細胞重定向雙特異性抗體的臨床試驗是在1990年,當時患有膠質母細胞瘤的患者接受了與抗膠質瘤抗原IgG化學偶聯的抗CD3 IgG。緊隨其后的是抗CD19×抗CD3雙特異性IgG樣大鼠/小鼠雜交雙特異性抗體的產生并在臨床研究中用于治療B細胞淋巴瘤。該抗體是第一個在臨床試驗中研究的靶向惡性B細胞的IgG樣T細胞重定向雙特異性抗體。

圖 2. T 細胞重定向雙特異性抗體(TRBA;上)和嵌合抗原受體(CAR)-T細胞(下)療法歷史上的關鍵里程碑。TRBAs引用的具體參考文獻有:Milstein和Cuello,1983;Staerz 等人,1985;Clark和Waldmann,1987;Nitta等人,1990;Haagen等人, 1992;De Gast 等人,1995;Mack 等人,1995;Ridgeway等人,1996;Zeidler等人,1999和L?ffler等人, 2000。引用的CAR-T開發的具體參考文獻有:Rosenberg et al., 1988, Gross et al., 1989, Eshhar et al., 1993, Hwu et al., 1993和Moritz等人1994。
?
1980年代后期和1990年代的另一個重大進展是發現了通過Fv的兩個結構域,可變重(VH)和可變輕(VL)結構域連接在一起來生成單鏈可變片段(scFv)抗體構建體的方法。短的柔性接頭,然后通過肽接頭將兩個scFv融合在一起以產生第一個雙特異性T細胞接合劑(BiTE?)樣抗體(圖 2)。第一個BiTE?用一個scFv靶向靶細胞上的腫瘤抗原17-1A,另一個scFv臂靶向T細胞上的CD3。
抗CD19×CD3 BiTE?的首次描述是在2000年。1990年代最后的重大進步是由Genentech的科學家產生了現在眾所周知的不對稱異二聚體Fc平臺“knobs-into-holes”(KIH)(圖 2)。該平臺成為整代IgG樣不對稱雙特異性抗體的原型,該抗體在CH3結構域中進行修飾,以形成異二聚體抗體。
在設計具有兩條重鏈的生產細胞系后,一條具有“旋鈕”或突出的氨基酸殘基,在CH3結構域的界面區域發生突變,另一個具有補償性“孔”或小氨基酸殘基突變和兩個輕鏈鏈,由此產生的異二聚體可以在四種可能的HC-LC配對中形成,其中所需的形式只是抗體分子之一。該技術隨后通過使用常見的LC得到改進,以消除“輕鏈問題”,即輕鏈與正確的Fc半配對。
然而,有趣的是,在Merchant等人之后的十年的論文中,雙特異性抗體工程幾乎沒有取得任何進展,并且大部分活動僅集中在兩個臨床候選者上。然而,從大約 2007-2009年開始,人們對開發新的雙特異性抗體平臺并使用這些平臺制造TRBA和其他雙特異性抗體療法的興趣猛增,導致開發了超過100種不同的新平臺。
第一個被主要監管機構批準用于商業用途的TRBA和雙特異性抗體是catumaxomab(商品名Removab?),這是一種雜交的小鼠-大鼠IgG樣雙特異性抗體,靶向T細胞上的CD3ε,單臂和癌癥抗原,上皮細胞粘附分子(EpCAM),與另一臂。Catumaxomab似乎在2001-2002年期間首次進入臨床試驗,于2009年被歐洲藥品管理局(EMA)批準用于治療惡性腹水。然而,由于其在人類中的高免疫原性(作為一種完全嚙齒動物的抗體)、狹窄且罕見的批準適應癥(即惡性腹水)以及隨后的銷售不佳,Removab?在2014年之后并未積極上市,并在2014年被其贊助商自愿停產。2017年,Removab?從未獲得美國食品和藥物管理局(US-FDA)的批準。
第二個被批準用于治療用途的T細胞重定向抗體是blinatumomab(商品名Blincyto?),一種基于片段的雙特異性抗體,稱為BiTE?,其中兩個單鏈可變片段(scFvs),一個靶向B細胞抗原、CD19和其他CD3ε用一個短的、五個殘基(G4S)1接頭連接在一起,即:((VLCD19-(GGGGS)3-VHCD19)-GGGGS-(VHCD3-(GGS)4GG-VLCD3ε)) 。Blinatumomab最初被稱為Micromet MT103(又名MedImmune MEDI-538),于2006年首次進入臨床試驗。Blincyto?于2014年獲得美國FDA批準,用于治療費城染色體陰性B細胞急性淋巴細胞白血病(ALL),使其成為第二個被批準用于治療用途的TRBA。
在2008年的時間范圍內,僅在臨床試驗中研究了三種TRBA(catumaxomab)、blinatumomab和ertumaxomab,一種針對HER2的大鼠/小鼠TRBA,現在有59個獨特的臨床候選CD3ε結合TRBA要么已獲監管機構批準,要么正在臨床試驗中研究,另外兩個重定向NK細胞,總計61個TRBA(表 1)。
?
2. CAR-T細胞簡史
1970年代后期的研究清楚地表明,CTL能夠連續殺傷靶向癌細胞 。這一概念在邏輯上導致了利用自體腫瘤浸潤淋巴細胞(TIL)的力量來治療它們來源的腫瘤的想法。對于這種方法,從人類腫瘤中采集TIL,離體擴增4到8周,然后與一定劑量的白細胞介素2 (IL-2) 一起靜脈內重新給藥,以幫助刺激重新給藥的淋巴細胞。這種治療導致60%接受治療的患者的轉移性腫瘤消退。雖然這些結果是初步的,但它們清楚地證明了腫瘤特異性、擴增和活化的自體T細胞在癌癥治療中的潛在用途。
然而,使用自體TILs作為治療劑仍然缺乏強大的腫瘤靶向性和控制靶向哪些細胞的能力。1989年,Gross等人報道了第一個成功的具有已知和特異性人工結合能力的T細胞工程(圖 2)。將抗 2,4,6-三硝基苯酚(TNP)抗體的VH和VL鏈融合到TCR生成人工嵌合TCR。以這種方式改造的T細胞能夠以非MHC限制的方式殺死TNP包被的靶細胞。雖然這種工程細胞結構本身并不是我們今天所想的CAR-T細胞,但它直接導致了第一代CAR-T細胞的形成。
第一個靶向半抗原TNP的CAR由直接與人Fc受體γ鏈融合的scFv (VL-linker-VH) 組成,充滿了其短的細胞外結構域、跨膜結構域和免疫受體酪氨酸激活基序(ITAM)(圖 3)。CD3ζ鏈在序列和功能上與 γ 鏈高度相似,也被用作融合中的細胞內信號結構域。這些第一個 CAR-T細胞是用由抗體組成的CAR構建T細胞。
雖然CAR-T細胞的概念自1990年代初就已經存在,但僅在過去十年中,技術才發展到將其轉變為可行的“可制造”過程所需的程度。因此,類似于TRBA方法,CAR-T在概念上是古老的,但在功能上仍然相對年輕且正在發展。
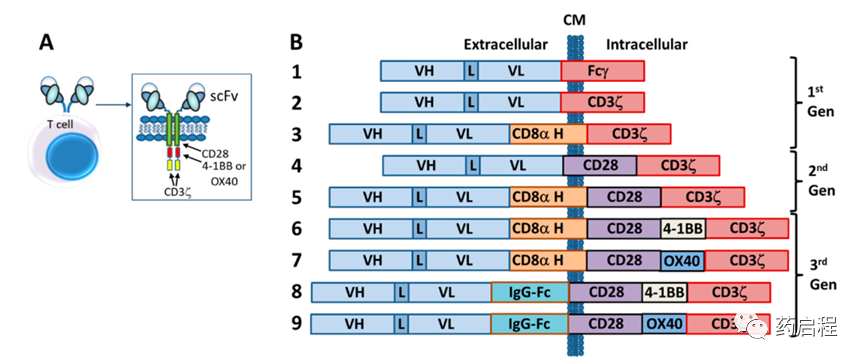
圖 3. CAR-T 細胞療法的代次。文中描述的幾代CAR-T細胞療法。(A)CAR-T的概括圖,顯示了 cFv與跨膜域和細胞內激活域的融合。(B)描繪文本中描述的第一代、第二代和第三代CAR-T結構示例的繪圖。
CAR-T細胞工程最早的“真正”癌癥靶點之一是細胞表面葉酸結合蛋白(后來被確定為葉酸受體(FR)),它被認為是卵巢癌的靶點。如上所述(圖 3),通過將源自抗FR抗體MOv18的scFv與Fcγ鏈融合構建了第一代抗FR CAR。用這種CAR(命名為Mov-γ)轉導的T細胞在體外殺死了FR+ IGROV-1卵巢腺癌細胞并增加了植入IGROV-1卵巢腺癌細胞的小鼠的存活率。該結構隨后被用于自體CAR-T治療卵巢癌患者的早期臨床試驗之一。由于第一代設計有限,使用Mov-γ CAR-T治療導致缺乏CAR-T持久性、向腫瘤部位的運輸不良,并且沒有減少任何患者的腫瘤負擔。在同一時期,莫里茨等人使用靶向HER2的CAR-T細胞系進行了首次臨床前體內研究(圖 2)。
使用CAR-T細胞進行臨床試驗的前兩份報告發表于2000年(圖 2)。三泰等人描述了用CAR治療HIV感染患者的方法,該CAR由人CD4的細胞外和跨膜結構域與CD3ζ的細胞內結構域融合,導致一些患者的病毒滴度暫時下降。此外,Junghans 等人報告了一項臨床試驗的結果,其中癌癥患者接受了針對癌胚抗原(CEA)的CAR治療。Eshhar回顧了使用CAR-T細胞的其他早期臨床研究。
第二代 CAR-T 細胞的設計是通過向γ鏈或CD3ζ CAR構建體添加來自共刺激受體的細胞質信號結構域,例如CD28、4-1BB (CD137)或OX40 (CD134) (圖 3)。這些構建體通常會導致活化細胞因子(如 IL-2 和 IFN-γ)的產生增加,增加抗原依賴性體外增殖和上調凋亡因子(如 Bcl-XL)。然而,即使使用第二代CAR T細胞激活似乎仍未完成 。因此,設計了一系列第三代CAR,并開始將其納入今天的臨床試驗。第三代CAR結合了CD28的內部結構域以及來自OX40 (CD134)或 4-1BB (CD137)的細胞內信號結構域(圖 3),從而產生具有增殖和增強能力的溶細胞性T細胞。增強它們的細胞殺傷活性和它們在循環中的持久性的生存信號。
隨后,證明最佳CAR活性需要更長、更靈活的“鉸鏈”區域(即細胞外間隔區,例如來自IgG-Fc或CD8α的區域)(圖 3),并且從那時起多年來,已經做出了重大努力來優化細胞外間隔物的長度和結構特征。
似乎很明顯,向CAR添加更多的T細胞激活信號會導致更強大的腫瘤細胞殺傷。盡管某些研究表明情況確實如此,但仍不清楚在每種情況下“越多越好”。各種體外和體內研究已經描述了依賴于CAR設計的工程化T細胞功能的改進和局限性。T細胞耗竭和無能,以及腫瘤微環境對T細胞通常產生的負面影響,涉及T細胞內精心編排的一系列信號,這些信號目前尚不被CAR工程所理解且不易適應。同樣,CAR分子結構的微調也被認為是一個需要改進的領域,因為完整的 T 細胞受體復合物的復雜物理化學性質開始被揭示。
Bispecific T-Cell Redirection versus Chimeric Antigen
Receptor (CAR)-T Cells as Approaches to Kill Cancer Cells
Antibodies 2019, 8, 41; doi:10.3390/antib8030041
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/10150.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃