CAR-T治療在腫瘤治療領域取得了顯著的突破,并在某些特定類型的白血病和淋巴瘤患者中取得了較好的臨床療效,但同時也需要對其進行不斷升級改造,以提高適用性和安全性。其中最主要就是在實體腫瘤的應用,因為實體瘤發病率最高且治療難度大。目前,CAR-T細胞療法在治療部分實體腫瘤,如轉移性黑色素瘤、肺癌、乳腺癌和結直腸癌等方面展現出一定的潛力。這些研究主要集中在尋找適當的腫瘤抗原,以及改進CAR-T細胞的設計和性能,以提高對實體腫瘤的治療效果。其次,就需要考慮其安全性和副作用:盡管CAR-T細胞療法顯示出強大的抗腫瘤活性,但它也伴隨著一些副作用和安全性問題。最常見的副作用是細胞因子釋放綜合征(CRS)和神經遞質釋放綜合征(CAR-T細胞相關性腦病,CRES)。此外,CAR-T細胞療法還可能導致貧血、血小板減少和感染等其他副作用。隨著對CAR-T細胞治療的深入研究,研究人員正在努力改進CAR-T細胞的設計和治療方案,以減輕副作用并提高安全性。
在開始正式解讀文獻之前,我們先來簡單了解一下CAR-T治療的過程,其大致分為以下幾個步驟:
?
1.T細胞采集:從患者的血液中提取T細胞;
2.基因改造:將基因工程技術應用于T細胞,將其轉導為攜帶CAR(嵌合抗原受體)的細胞;
3.體外擴增:將改造后的CAR-T細胞進行體外擴增,使其數量增多;
4.治療注射:將大量的CAR-T細胞重新注射到患者體內;
5.殺傷腫瘤:CAR-T細胞識別和結合腫瘤細胞表面的特定抗原,釋放細胞毒素,殺死腫瘤細胞。
6.持續觀察:對患者進行密切觀察,監測治療效果和可能的副作用。
近幾年,隨著科學家對CAR-T治療的研究不斷深入,科研工作者近些年已經通過各種改造升級手段,在對多種實體瘤的治療中也取得了不錯的進展。接下來,Immugent就通過聯合解讀幾篇高分文獻來系統解讀一下CAR-T突破實體瘤治療的破局之路。
1. 通過嵌合正交細胞因子受體增強CAR-T治療實體瘤效果
近兩年出現了很多改造CAR-T治療實體瘤的研究,其中最值得深入了解的就是在2022年由斯坦福大學的Christopher Garcia,賓夕法尼亞大學的Carl H. June以及加州大學洛杉磯分校的Antoni Ribas、Anusha Kalbasi等,在Nature雜志上發表的題為:Potentiating adoptive cell therapy using synthetic IL-9 receptors 的研究論文。其實早在2018年,同樣是Christopher Garcia作為通訊作者,就已經在Science發表論文,當時就已經提出了基于正交細胞因子及其受體的理念來改造CAR-T。
正交細胞因子受體是正常受體的一種突變形式,可選擇性地結合突變的細胞因子,而不與正常的細胞因子結合。在這項研究中,作者首先將正交小鼠IL-2受體o2R的ICD替換為γc(receptors for common γ-chain)細胞因子IL-4,IL-7,IL-9和IL-21受體的ICD,創建嵌合正交受體。并選擇oIL-2克隆3A10作為受體配體。分析篩選發現通過o9R的信號轉導導致STAT1,STAT3,STAT5有效磷酸化。這種效果與野生型IL-9受體已知信號傳導一致。隨后進一步分析發現o9R信號轉導是劑量依賴的,并且對MSA-oIL2具有特異性,并且o2R或者o9R的表達不影響野生型IL-2誘導的STAT信號傳導。
? ? ? ? ??
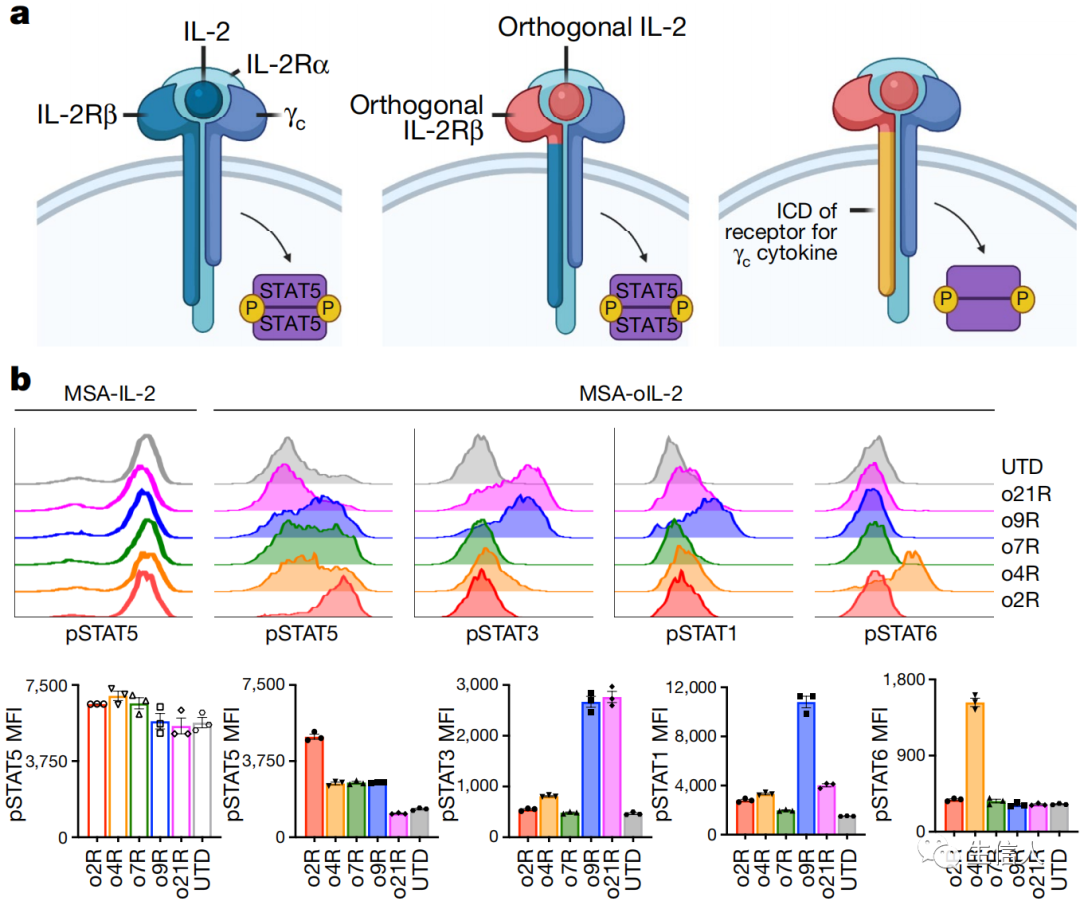
緊接著通過實驗,作者發現在這些γc細胞因子中,IL-9更值得研究——與其他γc 細胞因子不同,IL-9 信號在自然發生的 T 細胞中并不活躍。因此,人工合成的嵌合正交 IL-9 受體(o9R)將使過繼性 T 細胞在對抗腫瘤時更加強大。進一步研究發現,通過o9R發出信號的 T 細胞以伴隨激活STAT1、STAT3和STAT5 而區分,并呈現出一種獨特的干細胞和殺傷細胞的混合特性。與之前的o2R T細胞相比,o9R T細胞在兩種難治性的黑色素瘤和胰腺癌小鼠實體瘤模型中具有更好的抗腫瘤效果,最高治愈率超過50%!
作者接下來開始研究o9R在實體瘤過繼細胞療法中的體內信號轉導,他們使用轉基因pmel小鼠的T細胞,它表達內源性特異性gp100的T細胞受體,gp100是黑色素細胞抗原。在B16中過表達。研究發現pmel T細胞中o2R和o9R的STAT信號和細胞增殖可以反映野生型小鼠的o2R和o9R T細胞的狀況。評估發現在沒有淋巴清除的情況下,o9R pmel T細胞在該模型中可以延長小鼠生存期,實現較好的抗腫瘤作用。盡管o9R信號的增殖作用較弱,但是o9R可以改善腫瘤中T細胞浸潤,IFN-γ表達增加,o9R pmel T細胞體外溶細胞能力更高。作者通過RNA-seq也證實了這些表型。而且除卻與干細胞樣記憶T細胞的相關變化,作者還觀察到與T細胞經典激活表型相關基因富集。這表明這群細胞具有混合表型。

圖2
總的來說,這項研究表明,通過人工合成的正交 IL-9 及其受體 IL-9R,可以無需化療或放療清除免疫系統的情況下激活CAR-T細胞,使之獲得了新的功能,增強對難治性實體腫瘤的抗腫瘤活性,這些發現將為人類治療實體瘤打開了一扇新的大門。
2. 腫瘤特異性受體信號協助CAR-T進入冷腫瘤
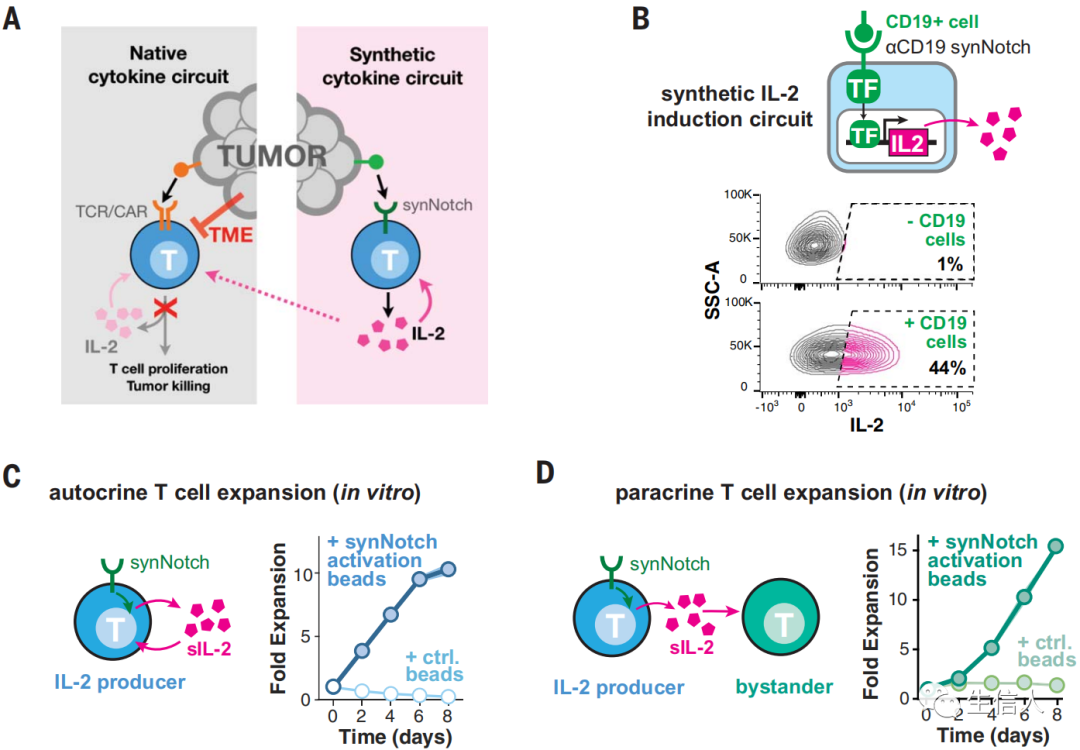
去年另一項有關改造CAR-T的重磅研究,是加利福尼亞大學舊金山分校Wendell A. Lim教授課題組在Science雜志上,發表的題為“Synthetic cytokine circuits that drive T cells into immune-excluded tumors”的論文。該研究專門針對嵌合抗原受體(CAR)T細胞,在對具有免疫抑制微環境的實體瘤(冷腫瘤)治療無效的問題,作者設計了腫瘤特異性synNotch受體局部誘導細胞因子IL-2產生的信號回路。
這些信號回路有效地增強CAR T細胞浸潤和清除免疫排斥型腫瘤,并且沒有全身毒性。最有效的IL-2誘導回路繞過抑制機制以自分泌和T細胞受體(TCR),或CAR獨立的方式起作用。這些工程細胞在靶腫瘤中建立了立足點,合成Notch誘導的IL-2產生能夠啟動CAR介導的T細胞擴增和細胞殺傷。因此,有可能重建合成T細胞回路,以激活抗腫瘤反應最終所需的輸出,但其方式避開了腫瘤抑制的關鍵點。
?
?
隨后,研究者給synNotch-IL-2環路T細胞設計一種新型的AND門,治療性T細胞在觸發其充分的細胞毒性反應之前需要識別兩個抗原:T細胞活化所需的TCR抗原和誘導IL-2產生所需的synNotch抗原。在這種情況下,作者使用了anti GFP-synNotch→sIL-2合成細胞因子回路。通過要求TCR抗原(NYESO-1)和synNotch抗原同時存在。當同時表達anti-NY-ESO-1 TCR和anti-GFP synNotch→sIL-2環路的T細胞治療小鼠時,雙靶向的NY-ESO+/GFP+腫瘤體積顯著減小。
為了研究在完全免疫正常的小鼠腫瘤模型中局部IL-2產生的影響,研究者在原代小鼠T細胞中構建了anti-mesothelin CAR與synNotch-IL-2環路同時表達。隨后作者發現,改造后CAR-T細胞介導的殺傷作用使得腫瘤消退。
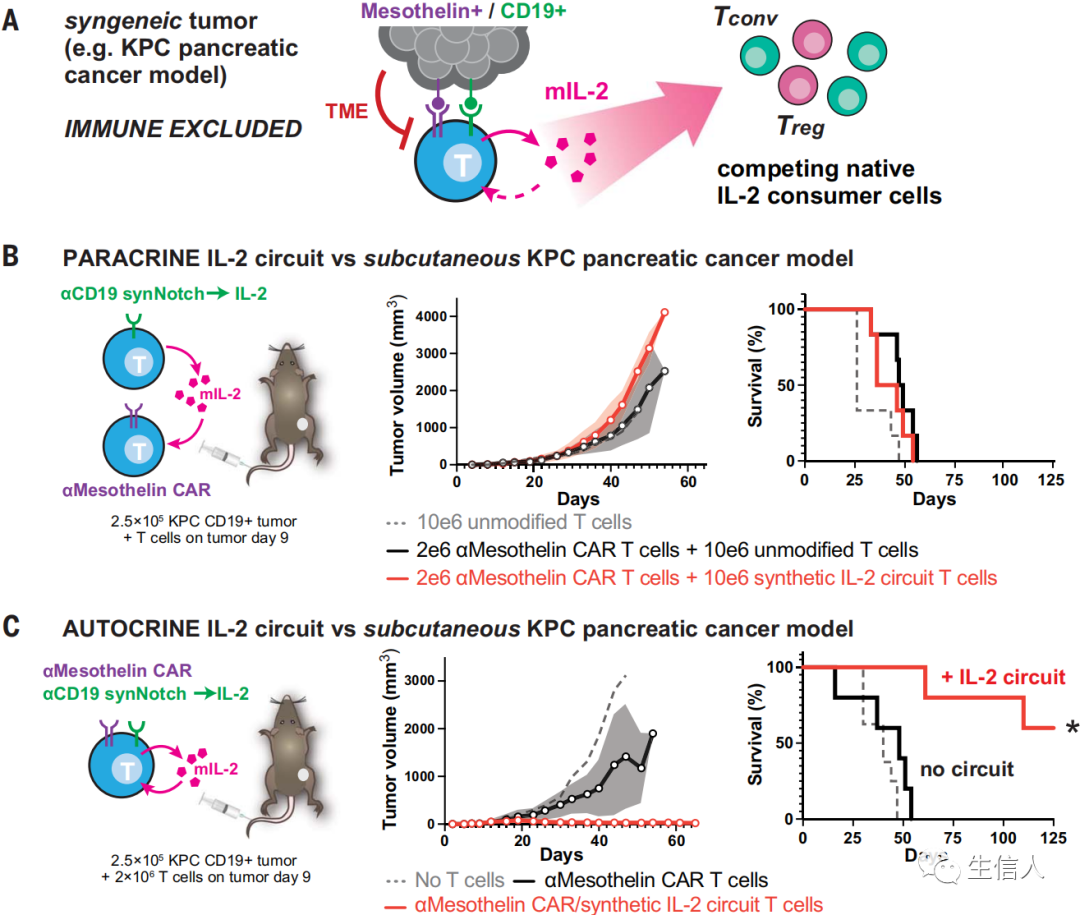
機體產生細胞因子的不同方式,對其成功發揮相應功能是至關重要的。首先,細胞因子的產生必須是動態調節的(可誘導的),但IL-2的持續產生可能加劇脫靶毒性。其次,要繞過腫瘤微環境對TCR/CAR的抑制,IL-2產生的誘導必須獨立于TCR激活途徑。作者通過研究發現,這一約束的一個有力解決方案是設計一種合成信號轉導途徑,該途徑是腫瘤觸發的,但繞過天然CAR/TCR激活途徑。使用檢測腫瘤的synNotch受體來驅動IL-2的產生,為實現這一目標提供了一種簡單而模塊化的方法。
3. 打造干細胞樣CAR-T發揮持久抗腫瘤作用
下面小編就來介紹兩篇今年剛發表的改造CAR-T細胞的研究成果,均在不同實體瘤上達到更好的治療效果。其中一項研究是澳大利亞Peter MacCallum癌癥中心的研究人員在Science Translational Medicine雜志上發表的題為:TSTEM-like CAR-T cells exhibit improved persistence and tumor control compared with conventional CAR-T cells in preclinical models 的研究成果。
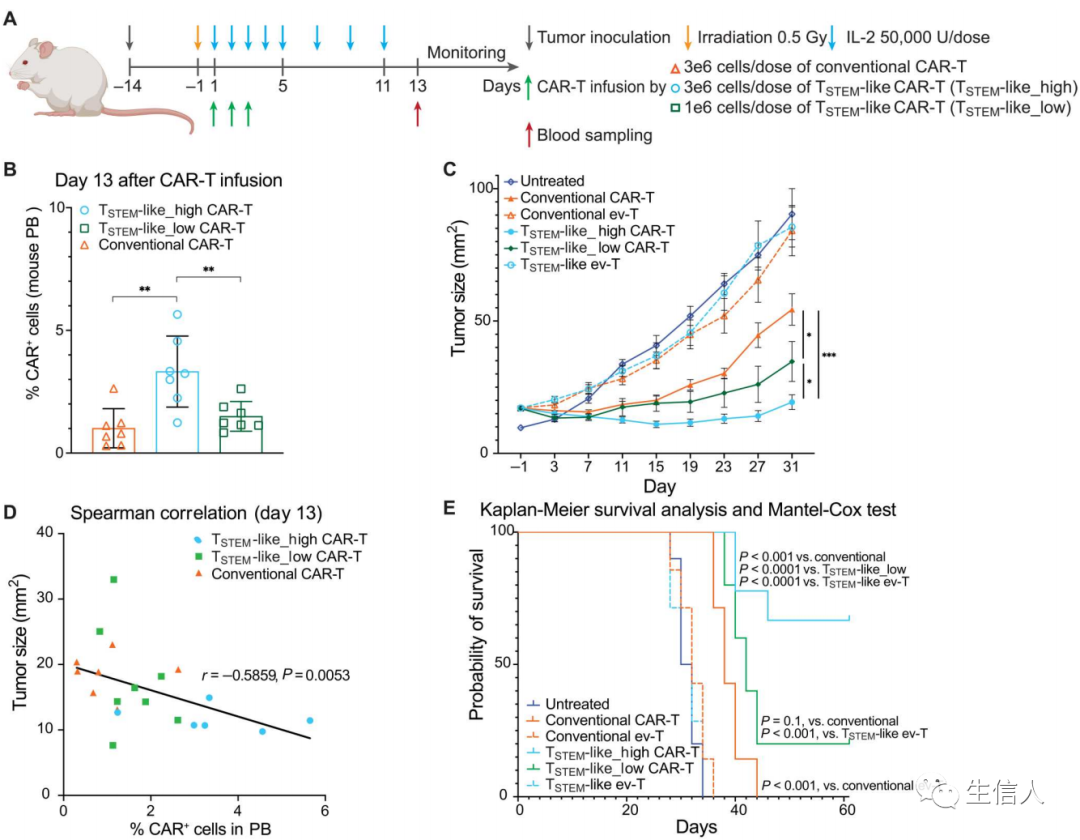
雖然目前FDA已批準了5款CAR-T細胞療法上市,用于治療白血病、淋巴瘤和骨髓瘤等血液瘤,但在更主要的癌癥類型實體瘤中,CAR-T細胞療法效果有限。這與CAR-T細胞擴增不良、持久性不佳以及T細胞耗竭等多種因素有關。為了解決這一難題,作者開發了一種基于干細胞樣T細胞(TSTEM)的新型CAR-T細胞療法,相較于基于傳統T細胞的CAR-T細胞,TSTEM CAR-T細胞擴增能力更強, 并在臨床前研究中證明其對實體瘤有效。同時,這也是CAR-T細胞療法在實體瘤治療中的重要突破。
? ? ? ? ??

圖5
?
為了解決這一問題,研究團隊開發了一種生產方案,以快速生成干細胞樣T細胞(TSTEM),可在短短6天內生成功能完善的TSTEM CAR-T細胞,而不是標準的14天,這為未來更經濟、高效的CAR-T細胞治療打開了大門。與傳統CAR-T相比,T-STEM CAR-T細胞增殖能力更強,細胞因子分泌也有所增加。這些反應依賴于在TSTEM CAR-T細胞生成過程中CD4+ T細胞的存在。隨后,作者在多個臨床前動物模型中,過繼移植TSTEM CAR-T細胞可以更好地控制小鼠腫瘤生長,以及抵抗腫瘤復發。這些更有利的結果與TSTEM CAR-T細胞持久性的增加和記憶T細胞庫的增加有關。
?
4. γδ CAR-T在骨轉移癌癥中表現優異
上述的所有研究都是集中在傳統的αβT細胞上,而最近發表在Science Advances雜志上的另一項篇名為:γδ-Enriched CAR-T cell therapy for bone metastatic castrate-resistant prostate cancer的文章,則是通過改造另一種固有免疫樣γδCAR-T細胞來實現更好的抗實體瘤的效果。我們常說的T 細胞其實是指αβT細胞,約占 T 細胞總量的65%-70%,其表面的 T 細胞受體(TCRs)由兩條糖蛋白鏈組成α 鏈和β鏈。而γδ T細胞是 T細胞的一個亞群,占所有 T 淋巴細胞的0.5%-5%,其 TCRs 由 γ鏈和 δ 鏈組成,主要存在于上皮和粘膜組織,比如皮膚、腸道等。雖然含量不多,但γδ T細胞沒有抗原特異性,因此具有更廣泛的腫瘤殺傷作用。
在這項研究中,作者采用了一種使用γδ的嵌合抗原受體(CAR)-T細胞和唑來膦酸鹽 (ZOL)治療骨轉移性前列腺癌(mCRPC)的組合策略。在骨mCRPC的臨床前小鼠模型中,靶向前列腺干細胞抗原 (PSCA) 的γδCAR-T細胞誘導腫瘤快速顯著消退,同時增加存活率并減少癌癥相關骨病。最終該研究的數據表明,內源性 Vγ9Vδ2 T 細胞受體的活性在CAR-T 細胞中得以保留,從而允許對腫瘤細胞進行雙受體識別。
?
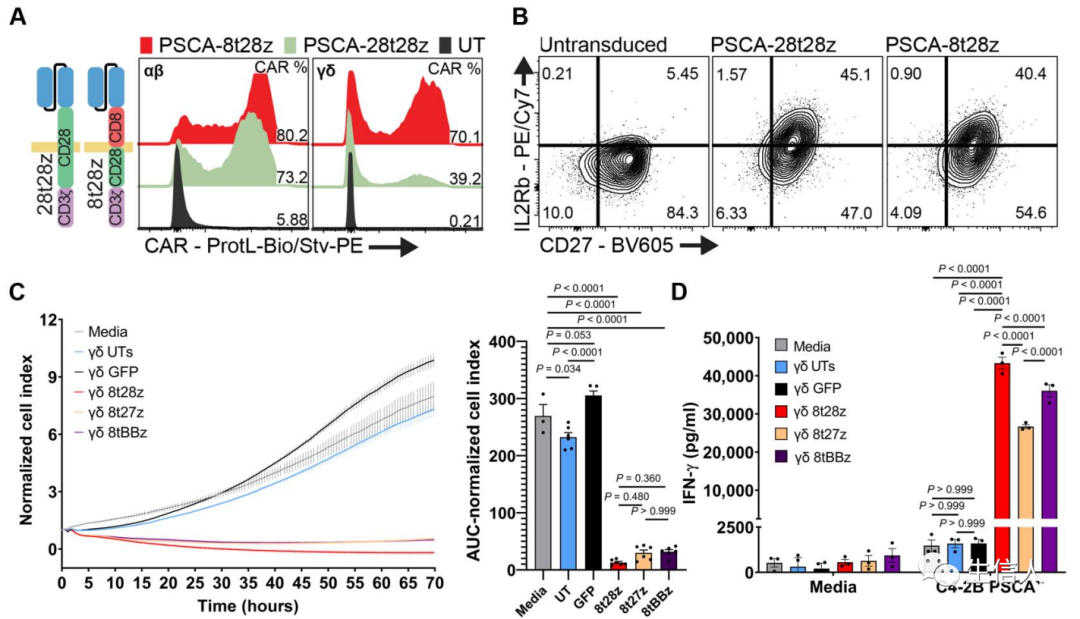 圖7
圖7接下來,他們將實驗轉移到小鼠模型上,結果表明CAR-T細胞顯著減小了腫瘤的大小并提高了存活率,而且毒性有限。為了評估抗PSCA 的γδCAR-T細胞在體內抗腫瘤活性,研究者將表達PSCA的C4-2B前列腺癌細胞(每次注射2.0×105個)接種到6 周齡小鼠的左右脛骨中雄性NSG (NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ) 小鼠 (n=10),并通過生物發光成像監測作為腫瘤負荷的讀數。
?
 圖8
圖8總而言之,這一研究是第一次評估γδT細胞表達CAR和治療骨轉移性前列腺癌。具有迅速達成臨床轉化的潛力,猜測用不了多久就會有類似的一款CAR-T申報mCRPC的臨床。
5.說在最后
通過系統解讀上述文獻,我們已經了解到最新開發出的多種提高CAR-T治療實體瘤的手段。無論是通過嵌合正交細胞因子受體,腫瘤特異性synNotch受體,還是生產干細胞樣T細胞的CAR-T細胞,這些針對傳統αβT細胞的改造方式;還是通過直接改造γδT細胞(沒有MHC分子限制),以提高其普適性;我們都可以看到近些年在針對實體瘤的CAR-T改造中取得了不錯的成果。可以說,這些研究成果都在不同角度上給我們提供了促進CAR-T殺傷腫瘤細胞的思路。
但除此之外,未來CAR-T發展方向還仍然主要從以下這些方面著手:
1.擴大適應癥范圍:目前CAR-T細胞療法主要用于治療血液系統腫瘤,如急性淋巴細胞白血病和非霍奇金淋巴瘤。雖然目前已經在動物模型中取得初步不錯的效果,或者在一部分黑色素瘤也有較好的療效,但未來CAR-T發展的首要任務仍然需要擴大適應癥范圍,將CAR-T細胞療法應用于更多類型的實體腫瘤,如肺癌、乳腺癌、結直腸癌等。研究人員將努力尋找更多的腫瘤抗原,并開發具有更廣泛抗原特異性的CAR-T細胞。
2.提高治療效果:CAR-T細胞療法在某些患者中取得了顯著的臨床療效,但仍有患者出現復發或無效的情況。未來的發展趨勢將集中在提高CAR-T細胞的治療效果和持久性。這可能包括改進CAR-T細胞的設計,以增強其腫瘤識別和殺傷能力,以及開發聯合治療策略,如與其他免疫療法、放療或化療的聯合應用。
3.減輕副作用:CAR-T細胞治療可能引發一系列副作用,包括細胞因子釋放綜合征(CRS)和CAR-T細胞相關性腦病(CRES)。未來的發展趨勢將集中在減輕副作用并提高治療的安全性。研究人員將尋找更好的管理和預防副作用的方法,并改進CAR-T細胞的構建和調控策略,以減少不必要的激活和副作用。隨著精準醫療的發展,CAR-T細胞治療也將朝向個體化治療方向發展。通過基因檢測和腫瘤特征分析,可以選擇最適合患者的CAR-T細胞治療策略。這可能包括選擇特定的CAR-T細胞構建、劑量和治療方案,以提高治療的針對性和效果。
4.生產和可及性改進:CAR-T細胞治療的生產過程復雜且昂貴,限制了其廣泛應用的可能性。未來的發展趨勢將包括改進生產工藝和降低成本,以提高CAR-T細胞治療的可及性和可持續性。新的生產技術和自動化系統的引入可能會加速CAR-T細胞的生產和供應,只有將成本降下來才會使得CAR-T可以為更廣大的腫瘤患者帶來實質的幫助,要不然都是紙上談兵。
CAR-T細胞治療作為一種創新的腫瘤治療方法,在全球科研工作者的共同努力下,取得了令人鼓舞的進展。它不僅在血液系統腫瘤的治療中取得了顯著的成功,并在實體腫瘤領域也顯示出巨大的潛力。然而,CAR-T細胞治療仍面臨著一些挑戰,包括浸潤到實體瘤中以增加治療效果、批量生產的成本和復雜性、副作用的管理等。隨著技術的進步和臨床經驗的積累,預計CAR-T細胞治療將逐漸得到改進和優化,可以為更多實體腫瘤患者帶來益處,并成為未來腫瘤治療領域的重要方式之一。
[參考文獻]
[1] Kalbasi A, Siurala M, Su LL, Tariveranmoshabad M, Picton LK, Ravikumar P, Li P, Lin JX, Escuin-Ordinas H, Da T, Kremer SV, Sun AL, Castelli S, Agarwal S, Scholler J, Song D, Rommel PC, Radaelli E, Young RM, Leonard WJ, Ribas A, June CH, Garcia KC. Potentiating adoptive cell therapy using synthetic IL-9 receptors. Nature. 2022 Jul;607(7918):360-365. doi: 10.1038/s41586-022-04801-2. Epub 2022 Jun 8. Erratum in: Nature. 2022 Dec;612(7938):E10. PMID: 35676488; PMCID: PMC9283313.
[2] Kalbasi A, Siurala M, Su LL, Tariveranmoshabad M, Picton LK, Ravikumar P, Li P, Lin JX, Escuin-Ordinas H, Da T, Kremer SV, Sun AL, Castelli S, Agarwal S, Scholler J, Song D, Rommel PC, Radaelli E, Young RM, Leonard WJ, Ribas A, June CH, Garcia KC. Potentiating adoptive cell therapy using synthetic IL-9 receptors. Nature. 2022 Jul;607(7918):360-365. doi: 10.1038/s41586-022-04801-2. Epub 2022 Jun 8. Erratum in: Nature. 2022 Dec;612(7938):E10. PMID: 35676488; PMCID: PMC9283313.
[3] Meyran D, Zhu JJ, Butler J, Tantalo D, MacDonald S, Nguyen TN, Wang M, Thio N, D’Souza C, Qin VM, Slaney C, Harrison A, Sek K, Petrone P, Thia K, Giuffrida L, Scott AM, Terry RL, Tran B, Desai J, Prince HM, Harrison SJ, Beavis PA, Kershaw MH, Solomon B, Ekert PG, Trapani JA, Darcy PK, Neeson PJ. TSTEM-like CAR-T cells exhibit improved persistence and tumor control compared with conventional CAR-T cells in preclinical models. Sci Transl Med. 2023 Apr 5;15(690):eabk1900. doi: 10.1126/scitranslmed.abk1900. Epub 2023 Apr 5. PMID: 37018415.
[4] Frieling JS, Tordesillas L, Bustos XE, Ramello MC, Bishop RT, Cianne JE, Snedal SA, Li T, Lo CH, de la Iglesia J, Roselli E, Benza?d I, Wang X, Kim Y, Lynch CC, Abate-Daga D. γδ-Enriched CAR-T cell therapy for bone metastatic castrate-resistant prostate cancer. Sci Adv. 2023 May 3;9(18):eadf0108. doi: 10.1126/sciadv.adf0108. Epub 2023 May 3. PMID: 37134157; PMCID: PMC10156127.? ? ??
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/myxb/33588.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃