
“
利用干細胞來改善身體已經不是一件新鮮事兒了,很多朋友在感慨醫學變革的同時,也會對其展現出的”神奇“產生疑慮:
“為什么身體很多地方一旦有問題,都能通過靜脈回輸干細胞治療?回輸后的干細胞真的能‘對癥’起效嗎?”
作為一種新興技術,干細胞確實在很多地方上與我們的常識相悖,但并非沒有科學依據。本篇文章將以探究“干細胞的回輸路徑”為引,聊聊干細胞是如何實現精準定位的。
首先我們得明確:與一般化學合成的藥物不同,干細胞(MSC)本質是“活”的。
這種具有生命的功能單位,并不像化學藥物一樣生來就有明確的“目標靶點”,事實上,MSC在應對不同疾病的時候,都是憑借自身特性在做主動遷移。
可是人體結構那么復雜,經靜脈回輸被注入血液循環中的MSC,能夠找到正確的道路嗎?讓我們跟隨MSC的腳步,看看它們到底落地何處。
靜脈回輸后
MSC都到哪兒去了?
我們先來看《NUCLEAR MEDICINE AND BIOLOGY》上一則文章[1],研究人員通過給MSC打上“標記”,追蹤它們在晚期肝硬化患者(伴有脾腫大)體內的活性分布,以確定MSC的“回輸行動路徑”。

△研究評估了4名肝硬化晚期患者經外周注入后MSC在體內的分布
不出所料,經靜脈回輸的MSC會率先在肺部聚集,待到2小時后,它們的蹤跡才能在肝臟及脾臟中被捕捉。但這種情況并非一成不變。研究人員觀測到,MSC會逐漸逃離肺部,遷移到肝臟及脾臟中。到第10天的時候,肺、肝和脾的殘留活性對比已經發生了完全逆轉。
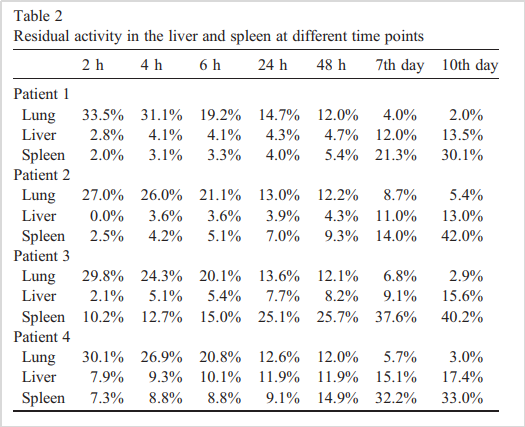
△實驗用?(111) In-oxine 標記 MSCs?,以此跟蹤MSCs在體內的分布
以Patient 1為例,他的肺部MSC殘留活性在10天中從33.5%下降到了2.0%,而肝臟部位的殘留活性從2.8%提到至13.5%,脾臟部位的更是從2.0%提高至30.1%。
以上說明:MSC回輸是一個循序漸進的“動態”過程,MSC在經靜脈回輸后,會先去往我們的肺部,緊接著它們順著血液流向,逐漸向肝和脾轉移。
不光如此,我們還可以發現,經靜脈回輸的MSC會主動聚集到晚期肝硬化患者急需改善的肝臟與脾臟,這是巧合,亦或是MSC的固定行動路線?
一篇發布于國際期刊《International Immunopharmacology》(影響因子:4.932)的文章[2]也許能給我們答案。

△研究中利用 CM-Dil 標記的 UC-MSC 治療了 T2DM 小鼠
這一次,研究人員就2型糖尿病(T2DM)小鼠探究人臍帶來源間充質干細胞(UC-MSC)的回輸去向,不同的地方在于,他們還新增了一個正常小鼠的對照組。
在經過大量人臍帶MSC回輸后,MSC初期的行動路徑也確實符合之前結論,它們會先來到小鼠肺部,然后逐漸經血管來到血流豐富的脾與肝。但與正常小鼠不同的是,T2DM小鼠體內會有一定數量的UC-MSC歸巢于的胰島,也就是體內受損部位。
這些歸巢于胰島的UC-MSC發揮了不俗的效用。研究者可以清楚地看到,在顯微鏡下T2DM小鼠胰島、肝臟、脂肪和肌肉中的M2巨噬細胞數量顯著增加,這些巨噬細胞可以減輕病鼠的胰島素抵抗,降低血糖。
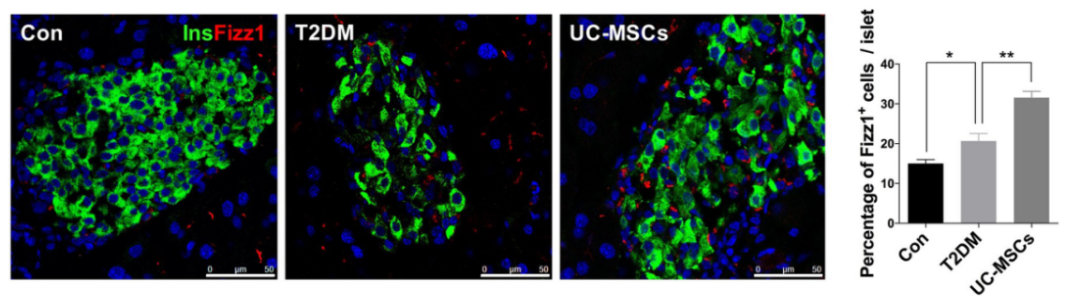
△UC-MSCs輸注可誘導胰島中M2巨噬細胞的增加,Fizz1+(綠色)
這項實驗給MSC進入體內路徑再添證據的同時,也證實了MSC會自動歸巢于機體的受損部位,它就像自帶GPS導航,能夠自動去往它該去的地方。
而這都得歸功于干細胞的“歸巢效應”,讓MSC可以無需指揮,就自動奔赴“戰場”。
自帶“GPS”導航
干細胞歸巢效應
作為干細胞最重要的三大機制之一,所謂干細胞歸巢,簡單理解就是:干細胞能憑各種信號分子找到機體“病灶”,并優先修復受損部位。
這個機制頻繁地在各類文獻、醫學新聞中露臉,卻鮮有文章會具體解釋干細胞實現歸巢的過程,這樣的“一筆帶過”也間接導致,對大眾而言,歸巢一直是個神奇的概念。
事實上,早就有科學家對歸巢過程做了較為完整的還原,他們甚至根據輸注方式的差異,將歸巢分為非系統性歸巢及系統性歸巢[3]兩類。
首先說非系統性歸巢,一般指在局部注射時發生的歸巢,當干細胞被定點移植到目標部位,干細胞會通過趨化因子濃度梯度被引導至受損部位,完成“歸巢”過程。
而“系統性歸巢”相較而言更為繁復,描述的是當干細胞被給予或內源性募集到血液循環中,經歷5個步驟(如下圖)后遷移至損傷部位的過程。
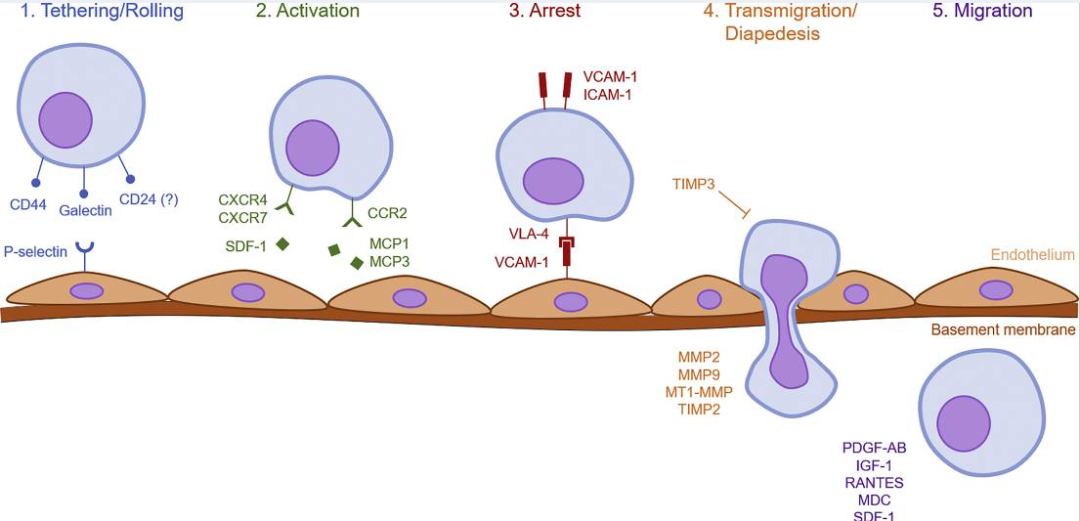
△促進干細胞系統性歸巢每一步的分子機制概述
我們來捋一捋全過程:起因在于MSC上有一種名叫CD44的表面標記物,當其被注入血液循環中時,CD44會被內皮細胞表達的選擇素(P-selectin)所束縛,導致干細胞只能沿著脈管系統壁滾動。
接下來就輪到G蛋白偶聯趨化因子受體登場了,它的作用在于:能響應機體中的炎癥信號,激活間充質干細胞表達 VLA-4,促進干細胞向受損部位遷移,這相當于給“歸巢”踩上了油門。可是光加速沒有終點也不行,干細胞該如何確定自己的目的地?
2018年,國際頂級期刊《Nature》(影響因子:49.962)以封面的形式發表了干細胞“歸巢”的全過程[4],其中提到了一群“引導細胞”,它是巨噬細胞的一種亞型,帶有血管細胞黏附分子VCAM-1。在歸巢過程中,它會站在血液“路口”巡邏,與經過的干細胞上的“VLA-4”(α4(itga4)和β1(itgb1)亞基組成)進行結合,扣住干細胞,使它”知曉“這才是自己該去的地方。

△中國科學院在國際上首次高清揭秘干細胞在體內歸巢全過程
此時,有了目標的干細胞會分泌基質金屬蛋白酶 (MMP) 撕開內皮基底膜,好讓自己能夠穿過內皮細胞層和基底膜。最終,根據損傷組織釋放的趨化信號(如生長因子血小板衍生生長因子-AB 、胰島素樣生長因子 (IGF)-1),使干細胞能精準到達臟器、骨髓等機體受損部位,并發揮功效。
在這種“歸巢效應”的加持之下,無論是腎臟、心臟、肝臟甚至于腦部出現問題,干細胞都可以通過靜脈回輸被輸送至受損部位,發揮其修復再生的積極作用。
目前,再生醫學界還在嘗試通過基因修飾、細胞表面工程、放射治療技術等來提高干細胞的歸巢效率。相信隨著各項技術的完善,干細胞治療技術在今后也將越發準確而有效。
Write in the last
寫在最后
我們在一個醫學快速變革的時代,許多技術、概念,或是治療手段都在被重新定義,而身處于信息浪潮中的我們,在保持懷疑的同時,更應該秉持理性與客觀的態度。畢竟,科學總能顛覆傳統。
部分圖片來自網絡
參考資料:
[1]?In vivo tracking of 111In-oxine labeled mesenchymal stem cells following infusion in patients with advanced cirrhosis . https://doi.org/10.1016/j.nucmedbio.2011.03.008
[2]?The homing of human umbilical cord-derived mesenchymal stem cells and the subsequent modulation of macrophage polarization in type 2 diabetic mice☆. https://doi.org/10.1016/j.intimp.2018.04.051
[3]?Mesenchymal Stromal Cell Homing: Mechanisms and Strategies for Improvement. https://dx.doi.org/10.1016%2Fj.isci.2019.05.004
[4]?VCAM-1 + macrophages guide the homing of HSPCs to a vascular niche. https://doi.org/10.1038/s41586-018-0709-7
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/gxb/7984.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃 





