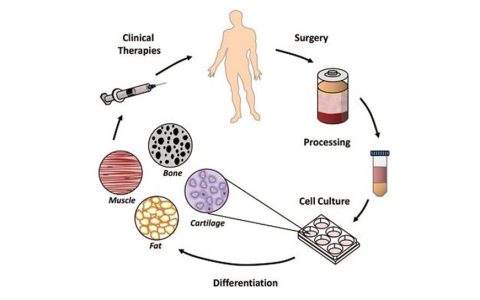
目前,間充質干細胞(MSC)藥物已經在許多國家批準上市,但是依然有不少人對間充質干細胞的安全性充滿疑慮。當然,這里指的是質量合格有保障的干細胞。
雖然不少動物實驗證明了輸入間充質干細胞的安全性,但臨床研究觀察和評價更具有意義。
根據美國臨床試驗數據庫ttp://clinicaltrials.gov,以“mesenchymal stem cell”為關鍵詞進行搜索,截止目前共有1230項間充質干細胞相關的臨床研究項目登記注冊。在全球獲批上市間充質干細胞產品有10余款。



所有研究中只有2項研究是前瞻性的非隨機試驗,其余的是隨機對照試驗(RCT),范圍從臨床試驗1/2期到3期。
其中臨床試驗數量亞洲排名第一,研究數量最多。其次是北美和歐洲。
這些研究中使用的間充質干細胞主要分離自骨髓、脂肪組織和臍帶。注射劑量范圍為4×107到1.2×109細胞。隨訪時間從6個月到2年。
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/gxb/36439.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃