“
從元宇宙到Chat-GPT人工智能的火爆出圈,科技創(chuàng)新正在成為驅(qū)動(dòng)一個(gè)國(guó)家發(fā)展的“源動(dòng)力”,誰掌握了科技“先機(jī)”,就如同把握住了發(fā)展的“命門”。
?
科技是中美之間最大的“戰(zhàn)場(chǎng)”,而“生物技術(shù)”已成為全球地緣政治競(jìng)爭(zhēng)的重要砝碼,美國(guó)也在加大對(duì)該領(lǐng)域的投資和研發(fā)力度,從頒布的各種政令可以看出美國(guó)為保持“競(jìng)爭(zhēng)優(yōu)勢(shì)”所做的努力,而中國(guó)作為“后起之秀”也是潛力無限。如今,中美在生物技術(shù)領(lǐng)域的競(jìng)爭(zhēng)已經(jīng)到了一個(gè)新階段,這不僅關(guān)乎兩國(guó)之間的科技實(shí)力,也關(guān)乎全球生命科學(xué)的未來發(fā)展。

讓我們把時(shí)間線先拉回到2022年。
為減少美國(guó)在生物技術(shù)領(lǐng)域?qū)χ袊?guó)的依賴,拜登政府簽署了《國(guó)家生物技術(shù)和生物制造計(jì)劃》,來“確保美國(guó)能夠在國(guó)內(nèi)制造于美國(guó)所發(fā)明的所有東西”。
雖然沒有明確提到“中國(guó)”,但仍有不少分析表示,所謂的生物科技令,實(shí)際是繼“芯片法案”后,拜登政府在高科技領(lǐng)域“針對(duì)中國(guó)”的又一舉動(dòng)。
2023年3月,作為行政令新“續(xù)集”,拜登政府頒布《美國(guó)生物技術(shù)和生物制造的明確目標(biāo)》[1]算是對(duì)去年的計(jì)劃做了回應(yīng)與補(bǔ)充,從幾項(xiàng)“大膽”又令人震撼的數(shù)據(jù)中看得出拜登政府為始終保持“競(jìng)爭(zhēng)優(yōu)勢(shì)”的決心。

·20年內(nèi)用生物基替代品取代90%以上的塑料;
·通過生物制造方式滿足至少30%的化學(xué)品需求;
·通過多種生物方式擴(kuò)大細(xì)胞療法規(guī)模,將成本降低10倍;
·7年內(nèi)減少農(nóng)業(yè)甲烷排放30%;
·5年內(nèi),對(duì)100萬種微生物進(jìn)行基因組測(cè)序,了解至少80%新發(fā)現(xiàn)基因的功能。
那么,美國(guó)緣何如此焦急又大手筆的布局生物醫(yī)藥?為促進(jìn)生物細(xì)胞發(fā)展,美國(guó)做了哪些“大膽嘗試”?中國(guó)生物科技的崛起又是怎樣形成了美國(guó)新威脅?其中種種還需娓娓道來。
為保持“競(jìng)爭(zhēng)優(yōu)勢(shì)”,
美國(guó)在生物細(xì)胞領(lǐng)域“大膽試錯(cuò)”
還記得2019年,國(guó)際干細(xì)胞協(xié)會(huì)(ISSCR)致函我國(guó)國(guó)家藥品監(jiān)督管理局,敦促取消衛(wèi)健委新發(fā)布的一項(xiàng)關(guān)于“允許醫(yī)療機(jī)構(gòu)的部分細(xì)胞療法毋需通過傳統(tǒng)的藥品審核流程便可售出”的體細(xì)胞療法的征求意見稿嗎? 也許彼時(shí)的ISSCR是想打壓下中國(guó)再生醫(yī)學(xué)團(tuán)體的激進(jìn),但現(xiàn)在回看來,美國(guó)的一系列操作似乎更加“大膽”,而美國(guó)在生物科技領(lǐng)域的“大膽”嘗試也不失為細(xì)胞科技發(fā)展向前推了一把。 由于FDA政策的嚴(yán)苛,致使美國(guó)的許多州走上了“自治”之路,開始自設(shè)寬松的細(xì)胞政策,其中最具代表性的要屬2017年6月,美國(guó)得克薩斯州率先為全球干細(xì)胞治療政策的破冰“打響了第一槍”。 該州頒布了一項(xiàng)非常寬松的干細(xì)胞法案,允許該州的診所和公司使用未經(jīng)FDA審批的干細(xì)胞治療,這意味著患者有權(quán)利自行選擇是否接受干細(xì)胞治療。 △ 得克薩斯州州長(zhǎng)Greg Abbott宣布法案生效,率先為全球干細(xì)胞治療政策的破冰“打響了第一槍” 法案的初衷是好的,但同樣也受到了不少質(zhì)疑,紐約大學(xué)生物倫理學(xué)家Beth Roxland認(rèn)為,這項(xiàng)法案對(duì)于患者的保護(hù)可能過于籠統(tǒng)。 但這似乎也沒有影響到法案的持續(xù)有效,為了讓更多“病入膏肓”的患者擁有“第二次生命的機(jī)會(huì)”,美國(guó)政府也積極通過了一些可能有意義但同時(shí)也飽受爭(zhēng)議的政策。 先是2015年,萬眾矚目的《21世紀(jì)治愈法案》(21st Century Cures Act)在美國(guó)眾議院以絕大多數(shù)贊成票表決通過。該法案旨在積極推動(dòng)新藥研發(fā),加快審批過程,促進(jìn)藥品和醫(yī)療器械上市。 △ 美國(guó)眾議院近日以344比77的投票結(jié)果輕松地通過了爭(zhēng)論已久的“21世紀(jì)治愈法案”,它是新藥開發(fā)立法的又一個(gè)里程碑,不僅進(jìn)一步推動(dòng)FDA對(duì)新藥評(píng)審的改革,也賦予國(guó)立衛(wèi)生研究院(NIH)更多的研究資源,促進(jìn)基礎(chǔ)醫(yī)療研究的發(fā)展。 雖然并非都是呼聲,一些反對(duì)派指責(zé)法案可能會(huì)使一些療法或器械在臨床研究結(jié)果并不充足的前提下進(jìn)入市場(chǎng),為患者帶來安全隱患和金錢浪費(fèi)。 但不得不說,正是該法案的“大膽”嘗試讓生物醫(yī)藥達(dá)到了蓬勃頂峰,得益于此,多個(gè)治療白血病、淋巴瘤和惡性黑色素瘤等嵌合抗原受體T細(xì)胞產(chǎn)品(CAR-T)獲準(zhǔn)加快臨床試驗(yàn)進(jìn)程。 △ 目前全球已有7款CAR-T細(xì)胞治療產(chǎn)品上市 更重要的是,這件事觸動(dòng)了FDA,為了讓更多患者避免江湖騙術(shù)的蒙蔽,美國(guó)FDA在“21世紀(jì)治愈法案”的基礎(chǔ)上設(shè)立一個(gè)名為“再生醫(yī)學(xué)先進(jìn)療法(RMAT)”認(rèn)證的新政策,并對(duì)符合該認(rèn)證的療法給予一系列加速審批的優(yōu)惠政策。 具體來說,RMAT認(rèn)定是針對(duì)再生醫(yī)學(xué)療法的藥品開發(fā)審評(píng)加速程序,它允許再生醫(yī)學(xué)療法開發(fā)公司在臨床試驗(yàn)早期更頻繁地與FDA相互交流,進(jìn)入該路徑的RMAT產(chǎn)品可以申請(qǐng)優(yōu)先審查和加速審批。 FDA生物制品評(píng)價(jià)與研究中心致力于幫助患者盡快使用上被證明安全有效的再生醫(yī)學(xué)先進(jìn)療法,尤其是讓患有嚴(yán)重或威脅生命的疾病患者盡快用上有效療法。這也是RMAT認(rèn)定的初衷。 雖然《21世紀(jì)治愈法案》不涉及監(jiān)管問題,但從長(zhǎng)遠(yuǎn)來看,RMAT認(rèn)定會(huì)產(chǎn)生更積極和實(shí)際的影響。因?yàn)橐@得RMAT認(rèn)定資質(zhì),療法必須在臨床前試驗(yàn)中取得積極的結(jié)果,在RMAT生效的同年,FDA就已經(jīng)收到了17項(xiàng)RMAT認(rèn)定申請(qǐng),其中4項(xiàng)已經(jīng)通過了認(rèn)定審批[2]。 △ 四種產(chǎn)品已經(jīng)獲得再生醫(yī)學(xué)高級(jí)療法 (RMAT) 稱號(hào),可以更快地與該機(jī)構(gòu)進(jìn)行額外互動(dòng) 緊接著,2018年特朗普又簽署了一項(xiàng)“治愈法案”的姐妹篇“嘗試權(quán)法案”,旨在允許患者嘗試未經(jīng)審批的試驗(yàn)藥物。 或許是為了擁護(hù)特朗普政府,也或許是真的為了患者考慮,美國(guó)38個(gè)州的州議會(huì)通過類似法律,允許對(duì)病情太重、年紀(jì)太大、太年輕,或住得太遠(yuǎn)無法參與治療的病患開立試驗(yàn)藥物。 △ 特朗普按照競(jìng)選承諾簽署通過了《喬丹法案》,允許身患絕癥的晚期惡疾患者自擔(dān)風(fēng)險(xiǎn)嘗試未經(jīng)藥監(jiān)部門審批的實(shí)驗(yàn)性治療和藥物,該法案的名字按畫面中患有肌肉萎縮癥的男孩喬丹命名 政策的相對(duì)寬松自然帶來了細(xì)胞行業(yè)的繁榮發(fā)展,但也同樣帶來了治療亂象。 在過去那幾年,美國(guó)超過500家診所從事直接面向消費(fèi)者(DTC)的干細(xì)胞治療營(yíng)銷,2018年1月,《新英格蘭醫(yī)學(xué)雜志》(NEJM)在線發(fā)表了題為“Rejuvenating Regenerative Medicine Regulation”[3]的評(píng)述文章,抨擊了美國(guó)商業(yè)干細(xì)胞治療機(jī)構(gòu)打政策擦邊球,將一些未經(jīng)嚴(yán)格的臨床研究而證明安全、有效的干細(xì)胞產(chǎn)品用于臨床治療,并對(duì)患者造成了嚴(yán)重傷害。 △ 再生醫(yī)學(xué)法規(guī) 為此,美國(guó)FDA針對(duì)這一亂象,制定了更細(xì)致和嚴(yán)格的干細(xì)胞產(chǎn)品監(jiān)管的規(guī)范性文件,明確將干細(xì)胞產(chǎn)品納入“生物類”藥品進(jìn)行監(jiān)管和審批,從而增加了干細(xì)胞產(chǎn)業(yè)準(zhǔn)入門檻。 為了繼續(xù)打壓和嚴(yán)查非法干細(xì)胞診所,2018年“嘗試權(quán)法案”后美國(guó)又相繼出臺(tái)了很多政策與建議用以規(guī)范干細(xì)胞療法的使用。 尋找一種合理、有效的監(jiān)管途徑來規(guī)范細(xì)胞行業(yè)發(fā)展,美國(guó)算是“先行者”,可以說,美國(guó)的監(jiān)管政策是從不斷碰壁的亂象中走出來的,盡管目前細(xì)胞行業(yè)仍然需要更規(guī)范的標(biāo)準(zhǔn)建立,但這些大膽又充滿挑戰(zhàn)的政策確實(shí)也推動(dòng)了細(xì)胞行業(yè)的發(fā)展,這一點(diǎn),值得我們客觀看待。 芯片領(lǐng)域后, 美國(guó)為何又瞄準(zhǔn)了“細(xì)胞技術(shù)”?

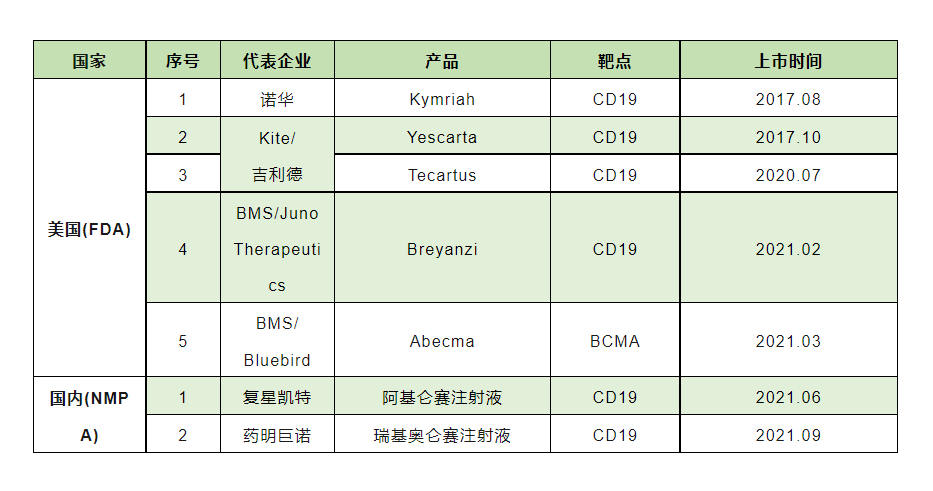



“芯片博弈”后,“生物技術(shù)”似乎成為了新的競(jìng)逐領(lǐng)域,那么美國(guó)為何又瞄準(zhǔn)了“細(xì)胞技術(shù)”呢? 作為科技發(fā)展的重要引擎之一,生物醫(yī)藥早已被確立為美國(guó)的支柱產(chǎn)業(yè)。有行業(yè)分析表明,在本世紀(jì)末之前,生物工程可能占全球制造業(yè)產(chǎn)出的1/3以上,價(jià)值接近30萬億美元。 此外,全球最重磅的藥廠、醫(yī)療器械企業(yè)、在醫(yī)學(xué)方面占據(jù)權(quán)威的高校、醫(yī)院,大多數(shù)都來自美國(guó)。在行業(yè)中最權(quán)威的“諾貝爾生理醫(yī)學(xué)獎(jiǎng)”,從1910年至2018年當(dāng)中216名獲獎(jiǎng)?wù)咧校?strong style="outline: 0px; max-width: 100%; box-sizing: border-box; overflow-wrap: break-word !important;">99位來自美國(guó),占總體的45.8%。足見美國(guó)在這方面的霸主地位。 這么一個(gè)龐大的行業(yè),最有可能出現(xiàn)顛覆性領(lǐng)域是哪一塊呢?答案就是細(xì)胞治療。 干細(xì)胞連續(xù)兩次被《科學(xué)》(Science)雜志列為世界十大科學(xué)問題之首,干細(xì)胞研究還在2007年和2011年獲得諾貝爾生理學(xué)或醫(yī)學(xué)獎(jiǎng)。 而免疫細(xì)胞治療領(lǐng)域,免疫細(xì)胞療法正在成為攻克人類癌癥的唯一有效方式,全球7款已上市的CAR-T細(xì)胞療法,更是掀起了一波科研狂潮,締造無數(shù)傳奇治愈神話。 △ 2016年奧巴馬和拜登啟動(dòng)“癌癥登月計(jì)劃”,利用免疫細(xì)胞治療癌癥曾受萬人擁戴。圖為 “癌癥登月計(jì)劃”特別工作組的第一次會(huì)議 美國(guó)FDA在幾年前曾預(yù)計(jì),“到2025年,F(xiàn)DA每年將批準(zhǔn)10-20款細(xì)胞和基因療法。”麥肯錫近期的一份報(bào)告則基于管線進(jìn)展做出更大膽的預(yù)測(cè):“僅在2024年,預(yù)計(jì)將有多達(dá)21種細(xì)胞療法和多達(dá)31種基因療法獲得FDA批準(zhǔn)。” 這些預(yù)言能否實(shí)現(xiàn)?或許這只是即將到來的浪潮的第一波。 近5年來,獲得FDA批準(zhǔn)的細(xì)胞和基因療法數(shù)量持續(xù)增長(zhǎng),當(dāng)前這一領(lǐng)域還有超過2000項(xiàng)臨床試驗(yàn)正在開展,其中超過100項(xiàng)已邁入3期。根據(jù)公開信息,在可預(yù)見的2023年,就有多達(dá)16款全新的細(xì)胞或基因療法有望在全球首次獲批。 △ 全球細(xì)胞治療藥物處于 II、III 期和上市的管線分布 如此“細(xì)胞藍(lán)海”,美國(guó)當(dāng)然不想錯(cuò)過,正如此次拜登政府頒布的《美國(guó)生物技術(shù)和生物制造的明確目標(biāo)》中明確提出的49大目標(biāo)就可以看出,拜登希望通過他的新政令改變現(xiàn)在國(guó)內(nèi)狀況,呼吁對(duì)應(yīng)用于制藥、農(nóng)業(yè)和能源領(lǐng)域的生物技術(shù)研究進(jìn)行更有針對(duì)性的投資,以保持美國(guó)的“競(jìng)爭(zhēng)優(yōu)勢(shì)”。 當(dāng)然,給美國(guó)造成“新威脅”的還有中國(guó)生物技術(shù)產(chǎn)業(yè)的蓬勃發(fā)展。 美國(guó)的“新威脅”, 中國(guó)國(guó)生物技術(shù)產(chǎn)業(yè)正在蓬勃發(fā)展
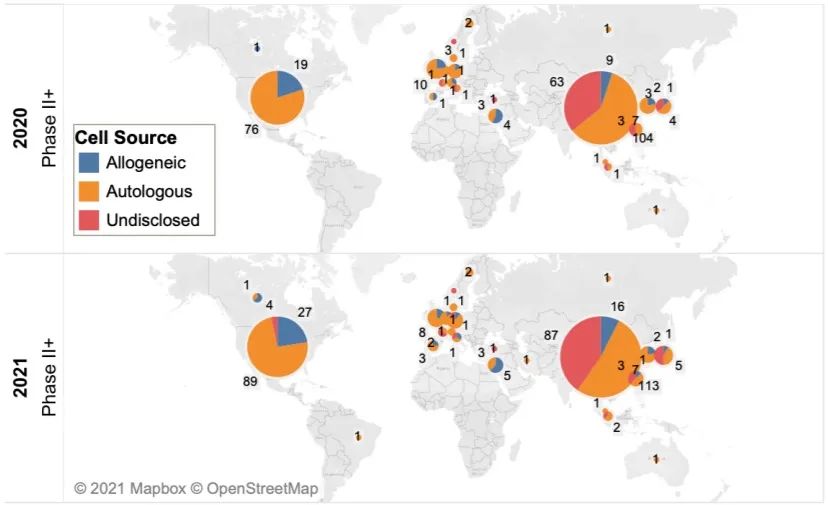
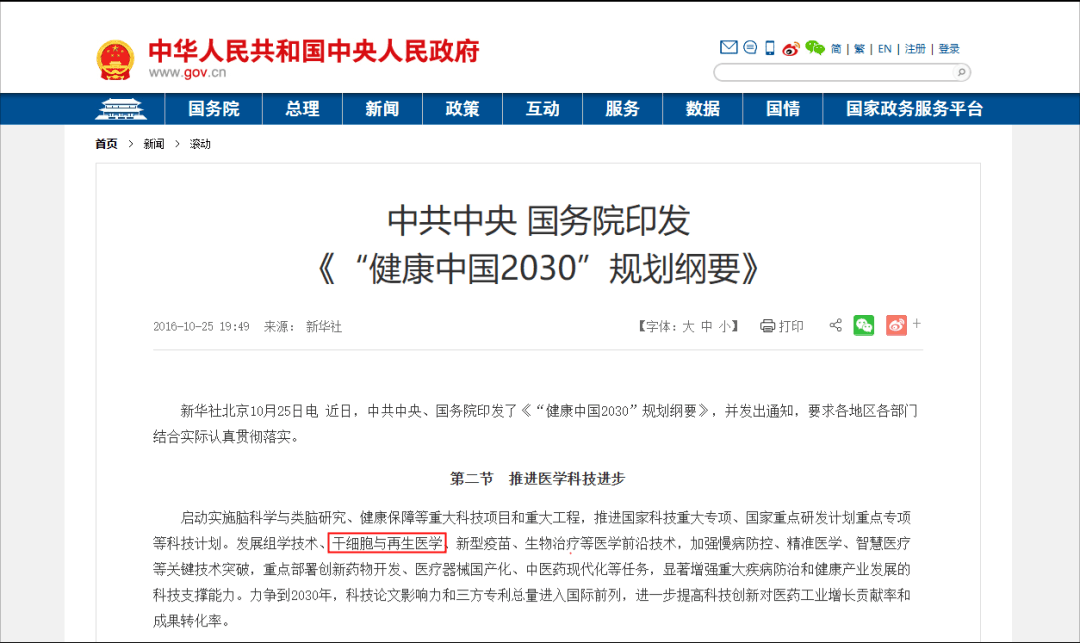
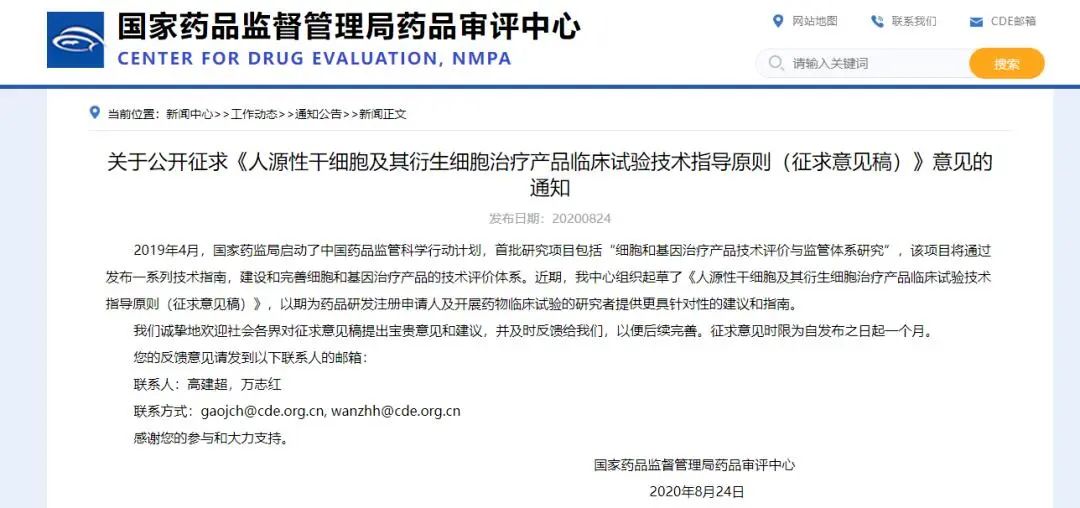
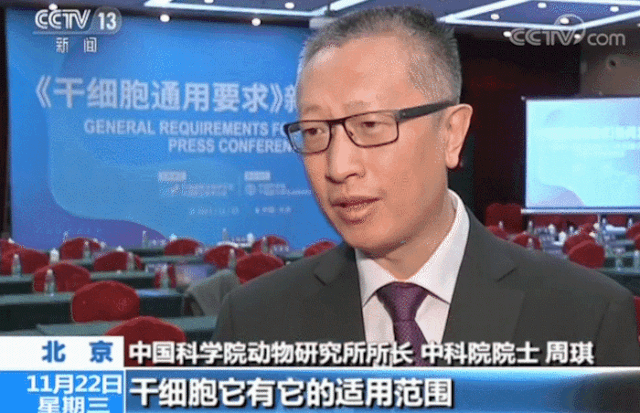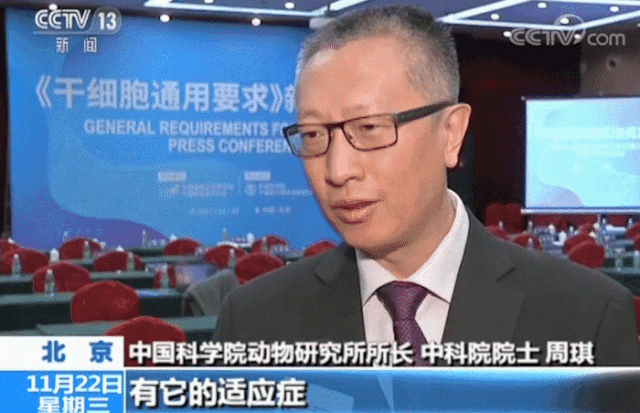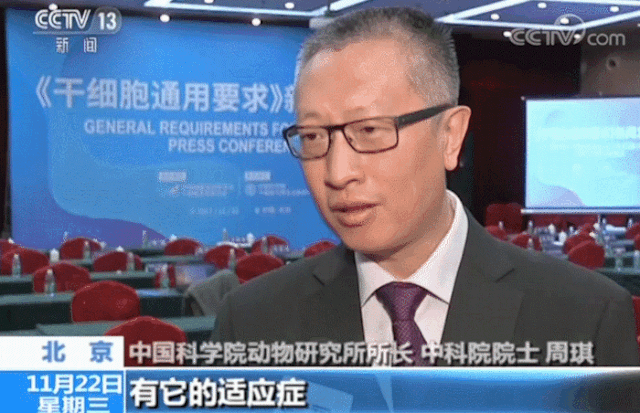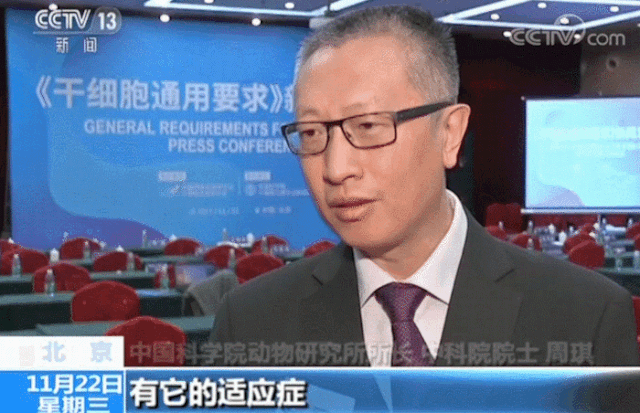
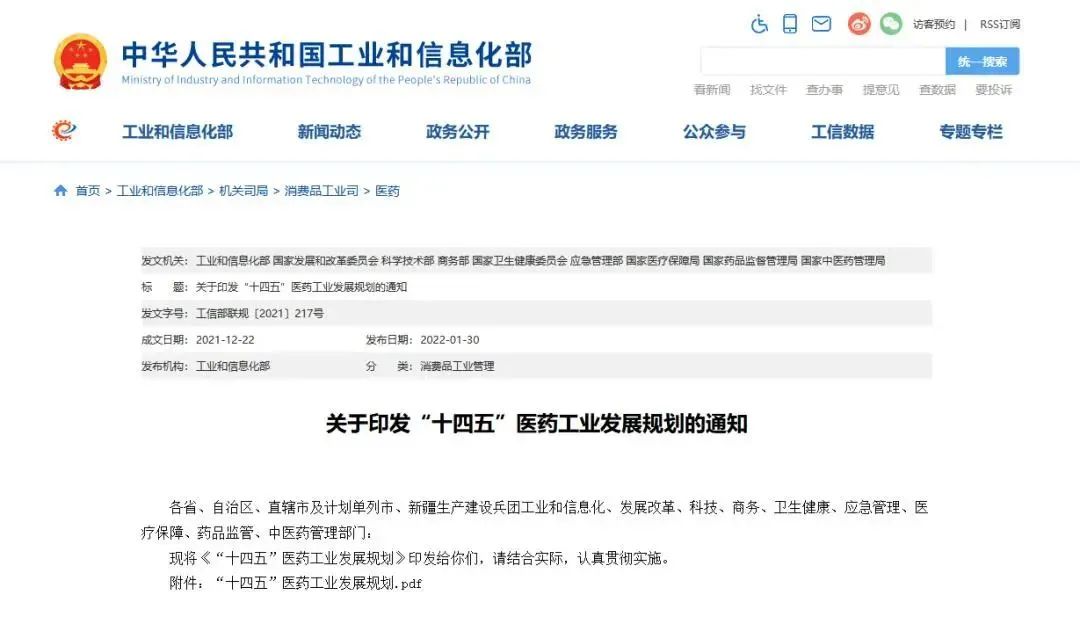
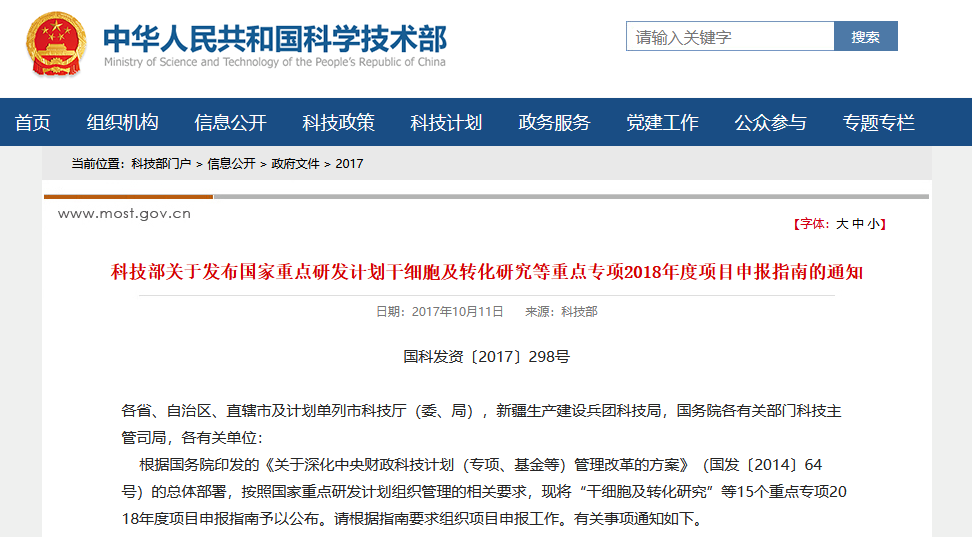
在生物技術(shù)研發(fā)創(chuàng)新領(lǐng)域,中國(guó)的發(fā)展速度不容小覷。 近年來,中國(guó)制藥行業(yè)已從生產(chǎn)低成本和大批量的仿制藥,轉(zhuǎn)向更加注重創(chuàng)新和研發(fā)新藥。黨的二十大報(bào)告將生物醫(yī)藥的創(chuàng)新,列為中國(guó)進(jìn)入創(chuàng)新型國(guó)家的重要標(biāo)志。目前,中國(guó)批準(zhǔn)上市新藥數(shù)量占全球15%左右,本土企業(yè)在研新藥數(shù)量占全球33%左右。 △ 2016-2020年我國(guó)新藥市場(chǎng)規(guī)模除2020年受疫情影響之外穩(wěn)定增長(zhǎng),2020年新藥市場(chǎng)規(guī)模為8449億元,2021年增長(zhǎng)至10291億元。 美國(guó)的多項(xiàng)報(bào)告也在發(fā)出“預(yù)警”,提示美國(guó)可能隨時(shí)會(huì)失去領(lǐng)導(dǎo)地位,中國(guó)的生物制藥業(yè)將在未來10年內(nèi)有望趕超美國(guó),成為世界最大擁有者。 從近年來我國(guó)在細(xì)胞行業(yè)頒布的政策可以看出,我國(guó)干細(xì)胞新藥研發(fā)進(jìn)展與監(jiān)管路徑的逐漸明晰,讓干細(xì)胞臨床轉(zhuǎn)化正在迎來發(fā)展“黃金期”。 早在2016年,中共中央國(guó)務(wù)院就將細(xì)胞醫(yī)學(xué)提高到了政策層面,“干細(xì)胞與再生醫(yī)學(xué)”被列為國(guó)家重大科技項(xiàng)目寫入《“健康中國(guó)2030”規(guī)劃綱要》。干細(xì)胞產(chǎn)業(yè)甚至還被列入我國(guó)“十三五”規(guī)劃、“十四五”規(guī)劃的國(guó)家發(fā)展戰(zhàn)略,這也是我國(guó)醫(yī)療科技發(fā)展的必然方向。 △ 中共中央國(guó)務(wù)院印發(fā)的《“健康中國(guó)2030”規(guī)劃綱要》 在監(jiān)管制度上,為鼓勵(lì)干細(xì)胞產(chǎn)業(yè)發(fā)展,我國(guó)細(xì)胞的細(xì)胞政策實(shí)行實(shí)行“雙軌制”,直接“對(duì)標(biāo)”美國(guó)的“雙軌制”,既可作為醫(yī)療技術(shù)申報(bào)備案,也可作為藥品申請(qǐng)上市,為干細(xì)胞的臨床轉(zhuǎn)化提速。 “雙軌制”指企業(yè)既可以按照2015年出臺(tái)的《干細(xì)胞臨床研究管理辦法》,作為醫(yī)療技術(shù)向國(guó)家衛(wèi)健委申報(bào)醫(yī)療機(jī)構(gòu)/項(xiàng)目備案;也可以按照2017年發(fā)布的《藥物注冊(cè)管理辦法(修訂稿)》,作為藥品(治療用生物制品),報(bào)國(guó)家藥監(jiān)局申請(qǐng)上市。 △ 2020年8月4日,國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心組織起草了《人源性干細(xì)胞及其衍生細(xì)胞治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見稿)》,以期為藥品研發(fā)注冊(cè)申請(qǐng)人及開展藥物臨床試驗(yàn)的研究者提供更具針對(duì)性的建議和指南 在規(guī)范細(xì)胞標(biāo)準(zhǔn)化方面,2019年,我國(guó)就出臺(tái)了首個(gè)干細(xì)胞通用標(biāo)準(zhǔn)——《干細(xì)胞通用要求》,為推動(dòng)我國(guó)干細(xì)胞領(lǐng)域的規(guī)范化和標(biāo)準(zhǔn)化發(fā)展發(fā)揮重大作用。 2022年,我國(guó)又牽頭制定了首個(gè)干細(xì)胞國(guó)際標(biāo)準(zhǔn)ISO 24603,以及另1項(xiàng)國(guó)家標(biāo)準(zhǔn)和7項(xiàng)團(tuán)體標(biāo)準(zhǔn),為干細(xì)胞研究、臨床應(yīng)用和行業(yè)發(fā)展制定了“準(zhǔn)則”,終形成中國(guó)干細(xì)胞領(lǐng)域的基本共識(shí),也是干細(xì)胞產(chǎn)業(yè)化的技術(shù)支撐和基礎(chǔ)保障。 △ 中國(guó)科學(xué)院動(dòng)物研究所所長(zhǎng)、中科院院士周琪在接受記者問時(shí)表示“規(guī)范我國(guó)干細(xì)胞臨床應(yīng)用規(guī)范化管理及推動(dòng)中國(guó)干細(xì)胞發(fā)展方面發(fā)揮重大作用” 而近年來,為大力發(fā)展生物經(jīng)濟(jì),我國(guó)更是將“生物經(jīng)濟(jì)”提高到國(guó)家層面,列入國(guó)家發(fā)展戰(zhàn)略寫入最新《“十四五”生物經(jīng)濟(jì)發(fā)展規(guī)劃》,尋求在未來十年超過美國(guó)的市場(chǎng)份額。 △ 國(guó)家發(fā)改委印發(fā)《“十四五”生物經(jīng)濟(jì)發(fā)展規(guī)劃》的通知 國(guó)家科技部、衛(wèi)健委、發(fā)改委、藥監(jiān)局等九部聯(lián)合印發(fā)《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》,明確將免疫細(xì)胞治療、干細(xì)胞治療、基因治療產(chǎn)品等納入規(guī)劃內(nèi)容,自此,干細(xì)胞正式被寫入我國(guó)第十四個(gè)五年規(guī)劃和2035年愿景目標(biāo)中,可見,國(guó)家對(duì)細(xì)胞行業(yè)的重視程度。 新興產(chǎn)業(yè)的發(fā)展當(dāng)然也離不開政府資金的支持,3年以來,“干細(xì)胞及轉(zhuǎn)化研究”重點(diǎn)專項(xiàng)連續(xù)3年獲得中央財(cái)政資助,總計(jì)超過20億元,在資金上可謂給足了“馬力”。 △ 科技部發(fā)布《“干細(xì)胞及轉(zhuǎn)化研究”等重點(diǎn)專項(xiàng)2020年度項(xiàng)目申報(bào)指南的通知》,僅2020年,國(guó)撥總經(jīng)費(fèi)2.40億元 或許在化藥研發(fā)方面,中國(guó)依然有落后于歐美發(fā)達(dá)國(guó)家,但干細(xì)胞卻是我國(guó)少有的在全球處于“并跑”地位的領(lǐng)域之一,是趕超國(guó)際,引領(lǐng)醫(yī)療趨勢(shì),對(duì)標(biāo)中國(guó)位置的全新領(lǐng)域,可以說,中國(guó)干細(xì)胞技術(shù)已處于世界領(lǐng)先水平。 △ 中國(guó)已獲準(zhǔn)開展IND的干細(xì)胞藥物數(shù)量的適應(yīng)癥范圍分布。從臨床備案數(shù)量及申報(bào)藥品數(shù)量上來看,在全球范圍內(nèi),中國(guó)與美國(guó)居于前列,歐盟緊隨其后。 當(dāng)然,作為細(xì)胞治療的“新寵兒”,中國(guó)的免疫細(xì)胞治療也在2021年迎來了里程碑式發(fā)展。2款CAR-T細(xì)胞療法的上市填補(bǔ)了國(guó)內(nèi)空白,也打消了從業(yè)者對(duì)細(xì)胞能否成藥的政策疑慮。 這也直接觸發(fā)了國(guó)內(nèi)細(xì)胞療法“井噴式”爆發(fā)增長(zhǎng),中國(guó)開展的CAR-T細(xì)胞產(chǎn)品臨床試驗(yàn)數(shù)量為全球第一,直接“比肩”美國(guó),與美國(guó)呈“雙雄爭(zhēng)霸”的格局。 △ 以 CAR-T、TCR-T、TIL 和CIK這四種常見的免疫細(xì)胞療法為例,美國(guó)和中國(guó)的臨床研究規(guī)模遠(yuǎn)超過其他國(guó)家,而中國(guó)以接近40%的年平均增長(zhǎng),不容小覷。 縱觀我國(guó)細(xì)胞治療政策,可以說是經(jīng)歷了從松到緊,從寬到嚴(yán)的一個(gè)循序漸進(jìn)過程,雖然沒有美國(guó)如此大膽嘗試,但作為一項(xiàng)關(guān)乎人類命運(yùn)的新技術(shù),也值得更多細(xì)致入微的變革,從以穩(wěn)妥為主到如今干細(xì)胞治療總體步入“快車道”,并入國(guó)家發(fā)展規(guī)劃,可以看出我國(guó)細(xì)胞治療正向著更加規(guī)范化、更加長(zhǎng)遠(yuǎn)的利于臨床轉(zhuǎn)化的方向發(fā)展。 而從更大的外部環(huán)境來看,人口老齡化、腫瘤年輕化,以及流行病毒持續(xù)反復(fù)肆虐的“助推”之下,中國(guó)細(xì)胞治療在腫瘤新藥研發(fā)、個(gè)體化醫(yī)療、精準(zhǔn)醫(yī)療和再生醫(yī)學(xué)等領(lǐng)域的應(yīng)用價(jià)值和地位也在不斷提升。 當(dāng)然,我們也應(yīng)該看到,中國(guó)的生物技術(shù)企業(yè)面臨著來自美國(guó)公司的競(jìng)爭(zhēng)和巨大壓力,盡管我們?cè)趧?chuàng)新和成本控制方面取得了很大進(jìn)步,但仍需更多的時(shí)間和資源與美國(guó)甚至世界競(jìng)爭(zhēng)。生物技術(shù)的發(fā)展需要高度的規(guī)制和倫理標(biāo)準(zhǔn),這是一項(xiàng)能夠改變?nèi)祟愇磥斫】蹬c福祉的領(lǐng)域,因此,中國(guó)的生物技術(shù)公司也需要投入更多資源和精力歷來應(yīng)對(duì)這些挑戰(zhàn)。 顯而易見的是,中國(guó)想要在全球擁有更多話語權(quán),仍需不斷奮進(jìn)。 Write in the last 寫在最后 在細(xì)胞治療領(lǐng)域,中美兩國(guó)都面臨著相同的挑戰(zhàn),我們應(yīng)該看到,生物技術(shù)已經(jīng)不是國(guó)與國(guó)之間的競(jìng)爭(zhēng)籌碼,面對(duì)全球人類共同面對(duì)的難治性疾病、癌癥、衰老等難題,共同合作,良性競(jìng)爭(zhēng)或許才是符合各方利益的最佳途徑。而我們應(yīng)該看到在這條路上不斷淬煉自我的意義。

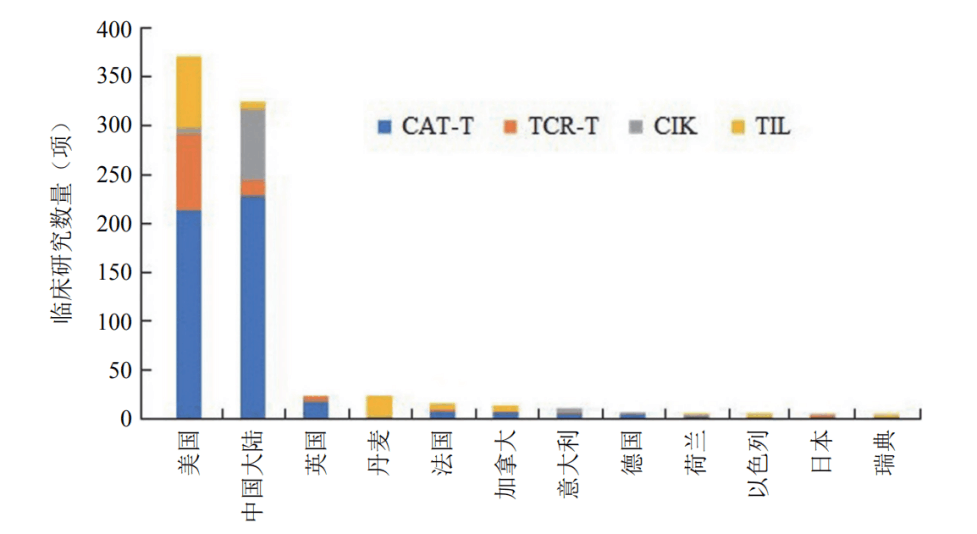
干細(xì)胞、免疫細(xì)胞治療都在與美國(guó)搶占市場(chǎng),而比起美國(guó)的大刀闊斧,或許中國(guó)的穩(wěn)中求進(jìn)更像是一只悶頭前進(jìn)的“雄獅”,不可估量的爆發(fā)力更讓人心生畏懼。
編輯:小果果,轉(zhuǎn)載請(qǐng)注明出處:http://www.448371.com/zixun/zcfg/29931.html
免責(zé)聲明:本站所轉(zhuǎn)載文章來源于其他平臺(tái),主要目的在于分享行業(yè)相關(guān)知識(shí),傳遞當(dāng)前最新資訊。圖片、文章版權(quán)均屬于原作者所有,如有侵權(quán),請(qǐng)及時(shí)告知,我們會(huì)在24小時(shí)內(nèi)刪除相關(guān)信息。
說明:本站所發(fā)布的案例均摘錄于文獻(xiàn),僅用于科普干細(xì)胞與再生醫(yī)學(xué)相關(guān)知識(shí),不作為醫(yī)療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃