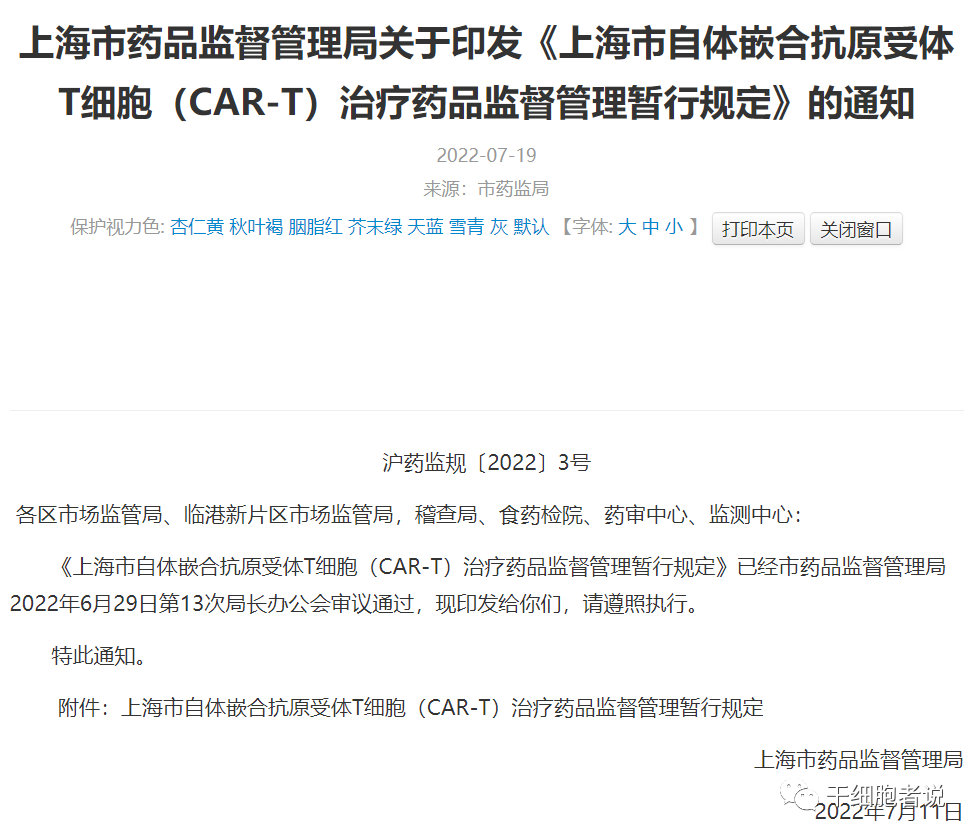
截圖來源:上海市藥品監督管理局
重點關注:

第二條(適用范圍)本市細胞治療藥品上市許可持有人(以下簡稱持有人)應當符合國家相關規定和本規定要求,確保細胞治療藥品質量,通過信息化手段實施藥品追溯,確保細胞治療藥品的安全性、有效性、質量可控性和可及性。
?
細胞治療藥品生產企業(以下簡稱生產企業)、細胞治療藥品經營、運輸和使用單位,細胞治療藥品使用的原輔料、包裝材料生產企業,以及其他從事與細胞治療藥品相關生產活動的單位和個人,應當符合本規定相關要求。
?
第三條(分工管轄)上海市藥品監督管理局(以下簡稱市藥品監管局)負責本市細胞治療藥品生產、批發和零售連鎖經營環節的質量監督管理工作,并指導區市場監督管理局(以下簡稱區市場監管局)開展細胞治療藥品零售、使用環節的質量監督管理工作。
?
各區市場監管局負責轄區內細胞治療藥品零售和使用環節的質量監督管理工作。
?
第四條(機構人員要求)持有人、生產企業應當獲得《藥品生產許可證》,設置與業務規模相適應的生產管理、質量管理、供應鏈管理、信息化管理等部門,具備符合細胞治療藥品生產要求的質量管理體系。持有人應當按要求設置藥物警戒部門。
?
生產管理負責人、質量管理負責人、質量受權人和藥物警戒負責人應當具有相關的專業知識和工作經驗,并能夠在生產、質量、藥物警戒管理中履行職責。生產管理負責人、質量管理負責人和質量受權人應當具有藥學、微生物學、生物學、細胞生物學、免疫學或生物化學等方面的專業知識。藥物警戒負責人應當具有醫學、藥學、流行病學或相關專業背景。
?
第五條(質量管理體系)持有人和生產企業應當建立符合《藥品生產質量管理規范》及其相關附錄要求,且與細胞治療藥品特點和生產形式相適應的質量管理體系。質量管理體系應當覆蓋原料、輔料和包裝材料供應商管理,供者材料驗收,藥品生產、儲存、配送和交接環節。采取委托生產方式時,持有人和受托生產企業的質量管理體系應當有效銜接。
?
第六條(生產工藝)持有人和生產企業應當嚴格按照《藥品生產質量管理規范》及其相關附錄和經藥品監督管理部門核準的藥品注冊標準和生產工藝進行生產。
?
對于生產工藝需要變更的,持有人和生產企業應當按照《藥品注冊管理辦法》《藥品上市后變更管理辦法(試行)》《已上市生物制品藥學變更研究技術指導原則(試行)》等要求,對生產工藝變更內容開展充分的驗證和研究,并依法取得批準、備案或者進行報告。
?
第七條(設施與設備)生產企業應當符合《藥品生產質量管理規范》及其相關附錄的要求,具有與生產方式和規模相適應的廠房和設備。細胞治療藥品生產應當在獨立廠房區域內進行,生產過程應當盡可能采用密閉系統和一次性耗材,減少污染和交叉污染的風險。
第八條(數字化追溯要求)持有人和生產企業應當保證生產活動全過程信息真實、準確、完整和可追溯,根據相關法律、法規、規章和標準要求,通過信息化手段實施生產過程追溯,建立覆蓋供者材料驗收、生產、檢驗、放行、運輸、交接等全過程數字化追溯系統。
?
每份供者材料及相應產品應當編制具有唯一性的編號代碼,用于標識和追溯。上市的最小包裝產品應當按照國家藥品監督管理局關于做好重點品種信息化追溯體系建設工作的要求,上傳藥品追溯信息。
?
第九條(生物安全要求)細胞治療藥品生產和檢驗應當符合《中華人民共和國生物安全法》以及相關規定要求,做好生物安全防護工作。
?
含有傳染性疾病病原體的供者材料和制得的細胞產品,應當在具備相應生物安全防護級別的單獨隔離區域進行生產和貯存,并采用專門的生產和儲存設備。
?
第十條(留樣管理)生產企業應當按照規定保存供者材料和細胞治療藥品留樣,留樣應至少保留至細胞治療藥品有效期后1年。在供者材料的采集量或細胞治療藥品的批產量較小時,為了保證患者用藥需求,可以根據《藥品生產質量管理規范》及其相關附錄調整留樣策略。
?
對于可能發生外源基因表達、表達載體存在基因整合或者重組風險的細胞治療藥品,生產企業應當進行長期留樣評估,納入評估樣品的保留期限應當相應延長。
?
第十一條(放行要求)持有人和生產企業進行細胞治療藥品生產放行和上市放行時,應當核對供者材料和細胞治療藥品的一致性,審查所有相關的原始數據、工藝過程記錄、環境監測及檢驗過程記錄,以及供者材料采集、運輸過程、驗收及儲存等記錄。當確認藥品生產符合工藝規程和質量標準時,方可作出藥品上市放行決定。
?
第十二條(供應鏈管理)持有人可以通過自建物流或者委托藥品經營企業、藥品物流企業等方式,建立細胞治療藥品供應鏈,防控儲運過程可能存在的風險,并制定突發事件應對預案,以保證細胞治療藥品的安全性、有效性、質量可控性和可及性。持有人可以參照相關規范或標準建立供應鏈。
?
參與細胞治療藥品供應鏈各環節的單位,應當具有符合細胞治療藥品配送儲存需要的冷鏈存儲設施設備、信息化設備、監控設備和質量管理體系及專業人員等,能夠實現全流程可追溯的質量監管。
?
第十三條(記錄保存)持有人和生產企業應當妥善保存供者材料采集、生產、檢驗、放行、銷售、運輸、復融及使用的全過程記錄,以及供應商審計、確認驗證、變更管理、偏差管理、自檢等質量管理工作和藥物警戒工作的記錄。批生產記錄至少保存至藥品有效期后1年,藥物警戒記錄和數據至少保存至藥品注冊證書注銷后10年,其他重要文件應當長期保存。藥品經營企業的采購、儲存、銷售、運輸等相關記錄及憑證應當至少保存5年。
?
第十四條(醫療機構審核)持有人應當對采集供者材料和使用產品的醫療機構(以下簡稱醫療機構)進行審核。醫療機構應當符合衛生健康部門關于血細胞單采相關技術要求、具備與臨床應用風險相適應的救治能力、接受持有人的培訓和評估。
?
持有人應當與通過審核的醫療機構簽訂質量協議。當發現醫療機構出現不符合操作規程,且可能會對患者健康造成不利影響的情況時,持有人應當及時要求醫療機構采取有效的糾正和預防措施。對于不能按照要求進行整改的醫療機構,持有人應當將其從合格醫療機構名單中剔除,并及時報告市藥品監管局。
?
第十五條(醫療機構名單發布)持有人應當在其網站發布通過審核的醫療機構名單,以方便患者查詢。醫療機構名單及變動情況應當通過市藥品監管局向相關醫療機構所在地省級藥品監督管理部門報告,供各省監管使用。
?
第十六條(藥物警戒)持有人應當按照《藥品不良反應監測和報告管理辦法》《藥物警戒質量管理規范》等要求,建立健全藥物警戒體系,設立專門機構,配備專職人員,開展藥物警戒工作,及時上報藥品不良反應報告和藥品定期安全性更新報告,主動開展上市后研究,按要求開展長期安全性隨訪,持續評估藥品的風險與獲益,對已識別風險采取有效的風險控制措施。
?
市藥品監管局根據監管要求對持有人藥物警戒工作進行檢查。
?
第十七條(年度報告)持有人應當按照《藥品年度報告管理規定》,按自然年度收集所持有細胞治療藥品的生產銷售、上市后研究、風險管理等情況,撰寫藥品年度報告并及時在線提交。受托生產企業、銷售企業以及其他有關單位和個人應當配合持有人做好年度報告工作。
?
第十八條(監督檢查)市藥品監管局依法對本市細胞治療藥品的持有人、生產企業、批發企業和零售連鎖總部進行監督檢查,對生產企業每年至少開展1次藥品生產質量管理規范符合性檢查和1次日常監督檢查,對持有人、批發企業和零售連鎖總部每年至少開展1次日常監督檢查。各區市場監管局依法對轄區內零售企業和醫療機構每年至少開展1次日常監督檢查。
?
市藥品監管局可根據需要,對本市持有人的受托生產企業和受托配送企業、藥用輔料和直接接觸藥品的包裝材料和容器生產企業等開展延伸檢查。
?
對有證據證明可能存在安全隱患的,市藥品監管局和區市場監管局根據監督檢查情況,應當依法采取告誡、約談、限期整改以及暫停生產、銷售、使用等措施,對違法違規行為依法進行處置。
?
第十九條(監督抽檢)鑒于細胞治療藥品的生產特殊性和倫理要求,在不影響患者用藥的前提下,市藥品監管局根據監督檢查需要,對本市企業持有的細胞治療藥品進行抽樣檢驗。企業應當配合提供符合產品儲運要求的包裝樣品。
?
第二十條(社會共治)本市藥品相關行業協會應當積極發揮引導作用,通過藥品安全宣傳教育、法律法規知識普及和年度信用評估等工作,督促本市細胞治療藥品企業加強自律規范,促進本市細胞治療藥品行業的高質量發展。
?
第二十一條(實施日期)本規定自2022年9月1日起施行,有效期2年,有效期至2024年8月31日。
信息來源:
https://yjj.sh.gov.cn/zx-yp/20220719/6c8b79b5702246ababa209fe007a72b1.html
編輯:小果果,轉載請注明出處:http://www.448371.com/zixun/hydt/15327.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃