熱休克蛋白是一類古老而高度保守的蛋白家族,在從古細菌到植物再到人類的所有生物體中均有發現。熱休克蛋白參與細胞內新生蛋白的折疊,對細胞內蛋白狀態進行實時監控,并且調控蛋白的降解及解聚等過程,以此維持細胞內穩態。
熱休克蛋白gp96自體免疫治療技術特點在于根據每個患者的腫瘤細胞在生物學、免疫原性、遺傳特征方面明顯的個體差異,特異性地給予免疫治療,有效地重新激活腫瘤患者的腫瘤特異性T細胞免疫功能,清除休眠的腫瘤細胞,防止腫瘤的發生和復發,延長患者生存期和提高患者生活質量。
gp96-抗原復合物作為自體免疫活性蛋白治療腫瘤療效已經在多例臨床試驗中得到了證明,安全性好,毒副作用低,沒有相關的Ⅲ或IV級不良事件的報告;療效好,有效延長患者總生存期和無病生存期。
下面,我們收集整理了國外已有熱休克蛋白gp96自體免疫治療腫瘤臨床試驗數據。
?結直腸癌?
gp96激活患者免疫系統在結直腸癌自身肝轉移患者的腫瘤中提取的HSPPC-gp96(Oncophage)疫苗接種于手術治療后的患者,誘導腫瘤特異性T細胞應答。在29例患者中,手術2年后患者總生存率和無病生存率分別為79%和32%(圖1)。有15例(52%)觀察到先前存在的I類HLA限制性T細胞介導的抗結腸癌反應發生了顯著的增加且未觀察到相關毒性。與無應答的受試者相比,有免疫應答的患者2年總生存和無病生存期顯著改善,獨立于其他臨床預后因素,具有統計學上顯著的臨床優勢(2年總生存為100%vs50%,P=0.001,圖2A;無病生存期為51%vs8%,P=0.0001,圖2B)。疫苗能顯著促進CD8+ T細胞對結腸癌的應答,使患者可以更好的無瘤生存[1]。
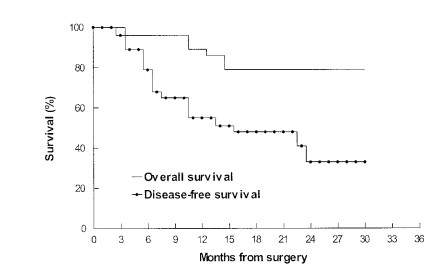
圖1 29例肝轉移的直腸癌患者術后接受gp96自體免疫治療的生存率。總生存率和無病生存率分別為79%和32%。中位隨訪為24個月。
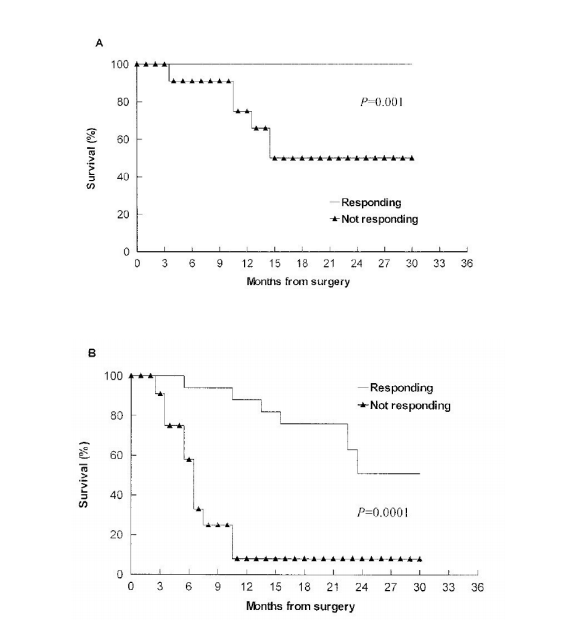
圖2 肝轉移的直腸癌患者術后接受gp96自體免疫治療后有免疫反應和無免疫反應的不同臨床結果。
還有研究發現,使用從黑色素瘤和結直腸癌患者的自體腫瘤組織中純化的熱休克蛋白gp96進行疫苗接種,大約50%接種疫苗的患者可以產生或增強黑色素瘤特異性T細胞應答,在經手術治愈的大腸癌肝轉移患者中也得到了類似的結果,表明該疫苗誘導的T細胞免疫應答與黑色素瘤(腫瘤應答)和結直腸癌患者(無病和5年總生存期)的臨床應答之間存在明確的關聯[2]。

接種自體腫瘤HSPPC-96疫苗后患者體內抗腫瘤T細胞和NK細胞增加。
熱休克蛋白除參與適應性免疫系統的激活外,對結直腸癌患者接種自體腫瘤提取的GP96,在NK敏感靶標存在的情況下,使自然殺傷細胞活性顯著增強。此外,即使在沒有單核細胞的情況下,CD56+淋巴細胞在體外接觸GP96時也會發生功能和表型激活,這支持了GP96對這些細胞亞群的潛在直接活性[3]。
?黑色素瘤?
在入選的36例患者中,72%為IV期黑色素瘤,83%之前接受過全身治療。自體腫瘤來源的熱休克蛋白肽復合物96 (HSPPC-96)以三種劑量水平之一制備(2.5、25或100 μg/劑量),全部36例患者均接受了治療,沒有發現嚴重的毒性反應。11名IV期??素瘤的患者的?進展?存率和總?存率分別為45%和82%,中位隨訪時間為10年。自體腫瘤源性HSPPC-96在所有試驗劑量下都是可行和安全的,觀察到的免疫效果和抗腫瘤活性適中,排除了生物活性劑量的選擇[4]。
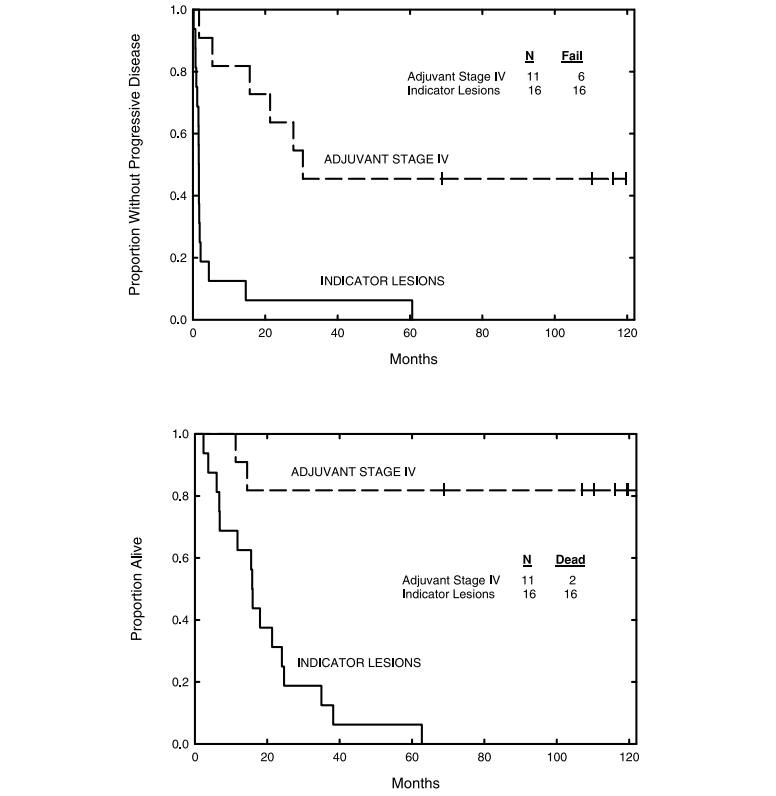
11名IV期??素瘤的患者的?進展?存率和總?存率分別為45%和82%,中位隨訪時間為10年。
第二項研究也確認了自體的、腫瘤來源的熱休克蛋白gp96肽復合物的抗腫瘤活性。患者(N=322)被隨機分配為2:1,接受含有達卡巴嗪、替莫唑胺、白細胞介素-2或gp96肽復合物治療。這項開放標簽試驗在全球71個中心進行,對患者的安全性和總生存率進行監測。結果表明gp96肽復合物對患者無明顯毒性。結果顯示,兩組的總生存率在統計學上無顯著差異,接受gp96肽復合物免疫的M1a和M1b亞期患者比接受較少此類治療的患者存活時間更長,但在M1c分期患者中未檢測到這種差異[5]。
?胰腺癌?
一項I期臨床試驗,確定從完全切除的胰腺腫瘤中純化自體疫苗HSPPC-96 (gp96, Oncophage)的可行性,并探討治療患者的免疫反應和臨床結果。受試者每周接種4次5μg自體HSPPC96疫苗,除此之外,受試者既未接受輔助化療,也未接受放療。10名患者接受了完整療程的疫苗接種后,未遇到劑量限制毒性且中位總生存期為2.2年(標準治療藥物吉西他濱單藥治療的中位生存期是6個月,顯著延長4倍)。10名接受治療的患者中有3人在2.6年、2.7年和5.0年隨訪時無病生存[6]。
?惰性非霍奇金淋巴瘤?
這項研究仍在進行中,迄今已有20名患者參加了這項Ⅱ期臨床試驗,這些患者的中位年齡為58歲(范圍45-83歲),成功制備了17例不同惰性組織(濾泡型,n = 9;小淋巴細胞,n = 6;邊緣區,n = 2),提示可從大多數惰性淋巴瘤患者中制備HSPPC-96,而不考慮其組織學亞型。患者接受了中位數4次疫苗接種(范圍1-14劑)。患者接受了中位數4次疫苗接種(范圍1-14劑),耐受性非常好,幾乎沒有觀察到不良影響。在可評估的患者中,濾泡性淋巴瘤、小淋巴細胞性淋巴瘤和邊緣區淋巴瘤的療效持續時間分別為8、12和13個月。數據初步表明,這種新型疫苗制劑在惰性淋巴瘤患者中的臨床治療是有效的[7]。
?膠質母細胞瘤?
復發性多形性膠質母細胞瘤(GBM)患者預后較差,可通過免疫治療改善。在一項開放標簽、單臂、Ⅱ期研究中,可手術切除的復發性GBM成人患者在全切除后接種自體熱休克蛋白肽復合物-96 (HSPPC-96)疫苗,主要終點是6個月的總生存期;次要終點包括總生存期、無進展生存期、安全性和免疫分析。在意向治療人群和療效人群中進行結果分析發現,在2007年10月3日至2011年10月24日期間,41例患者接受了復發性GBM的全切除,并接受了中位數的6劑HSPPC-96疫苗。治療后,90.2%的患者6個月存活(95%置信區間[CI]: 75.9-96.8), 29.3%的患者12個月存活(95% Cl: 16.6-45.7),中位總生存期為42.6周(95% Cl: 34.7-50.5)。27例(66%)患者在治療前淋巴細胞減少,淋巴細胞計數低于隊列中位數的患者顯示總生存期降低(風險比:4.0;95% Cl: 1.4-11.8;P=0.012),無治療相關死亡病例。報告了37例嚴重(3-5級)不良事件,其中只有1例與疫苗相關的3級機體不良事件。結論:HSPPC-96疫苗治療復發性GBM是安全的,值得進一步研究[8]。
另一項研究表明,多形性膠質母細胞瘤(GBM)腦組織中與gp96結合的多肽可用于復發性GBM患者的安全免疫。對12例復發性GBM患者在接受手術切除腫瘤提取的自體HSPPC96疫苗免疫前和免疫后進行多模式免疫監測。臨床終點包括安全性評估和總生存率。結果顯示:未發現與疫苗相關的不良事件。對接種疫苗前后外周血白細胞的檢測顯示,在12名接受治療的患者中,有11人出現了針對與gp96結合的多肽的顯著外周免疫反應。接種疫苗后免疫應答者的腦組織活檢顯示局灶性CD4+、CD8+、CD56+和IFNγ+細胞浸潤,與腫瘤部位特異性免疫應答一致。免疫應答者在手術和接種疫苗后的中位生存期為47周,而單個無應答者的中位生存期為16周。結論:這些數據表明個體患者對自體腫瘤源性多肽結合gp96產生特異性免疫反應[9]。
在一項開放標簽、單臂、I期研究中,成人患者在手術切除后新診斷的GBM患者聯合使用標準治療方法接種HSPPC-96疫苗。主要終點為不良事件發生頻率和6個月無進展生存期(PFS)。次要終點包括總生存率(OS)、PFS和腫瘤特異性免疫反應(TSIR)。2013年9月至2015年2月共入組20例新診斷的GBM患者。未發現3級或4級疫苗相關不良事件。中位隨訪時間為42.3個月,6個月時PFS為89.5% (95% CI, 66.9%-98.7%),中位PFS為11.0個月(95% CI, 8.2-13.8),中位OS為31.4個月(95% CI, 14.9-47.9)。接種疫苗后TSIR顯著增加2.3倍(95% CI, 1.7-3.2)。接種后TSIR高的患者的中位OS為>40.5個月(95% Cl,不可計算),而接種后TSIR低的患者的中位OS為14.6個月(95% CI, 7.0-22.2)(危險比,0.25;95%置信區間,0.071-0.90;P = 0.034)。多變量Cox回歸模型顯示疫苗接種后TSIR是生存的主要獨立凹陷預測因子。結論:HSPPC-96疫苗與標準療法相結合,是治療新診斷的GBM患者的一種安全有效的策略。疫苗接種后TSIR是預測疫苗療效的良好指標[10]。
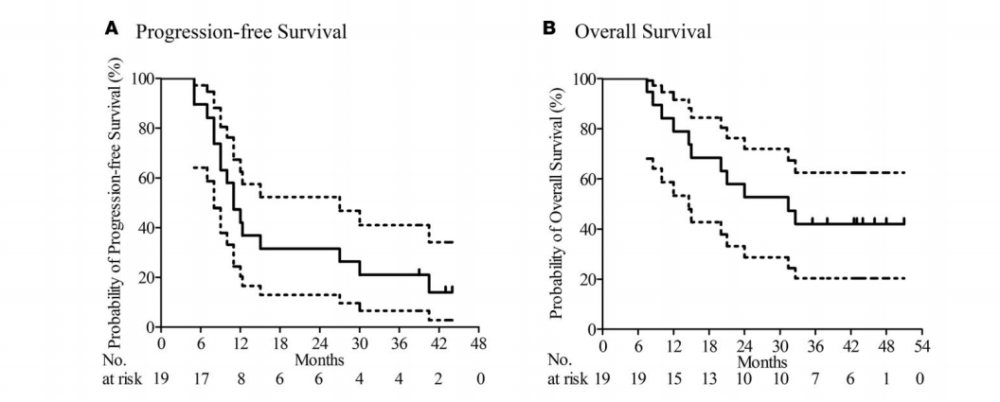
HSPPC-96疫苗接種后的臨床活動。Kaplan-Meier 估計(A)?進展?存期和(B) 19名接受 HSPPC-96疫苗治療新診斷的GBM的患者的總?存期。
?腎癌?
局限性腎細胞癌的治療包括部分切除或根治性切除,有研究前瞻性地檢查了腎切除術后接受熱休克蛋白肽復合物96 (HSPPC-96)疫苗治療的轉移性腎細胞癌患者的生活質量(QOL),對36例初診期腎細胞癌患者、治療3周后治療結束日及隨訪1個月時的生活質量和侵入思想進行測定。在每次評估中,患者完成RAND 36項健康調查和事件影響量表(IES)。混合模型分析顯示,隨著時間的推移,物理成分總結分數有顯著提高(p
結論:HSPPC-96疫苗治療期間,患者生活質量保持穩定或改善[11]。
另一項研究評估了在接受腎切除術的IV期轉移性腎細胞癌(RCC)患者中,通過使用與不使用白細胞介素-2 (IL-2,Chiron, Emoryville, CA, USA)的自體HSPPC-96(Oncophage, Antigenics Inc, New York NY, USA)的時間進展和應答率(RR)來確定臨床療效。84例患者被納入研究,然后接受了腎切除術和腫瘤組織的收集,用于自體疫苗生產。最初的治療計劃大約在術后4周開始,包括6次注射(疫苗在第1、2、3、4、6、8周注射)。然后在第10周或前后重新調整,病情穩定或反應性疾病的患者繼續接種疫苗,每兩周再接種四次疫苗(在第10、12、14、16周)。在第10周評估時病情進展的患者接受了連續4個每周5天的11 x 10U IL-2皮下注射療程(第10、11、12、13周)。每隔2周(第10、12、14、16周)使用4劑HSPPC-96。在下一次評估中,完全應答的患者再接受兩個周期的HSPPC-96疫苗,或直到疫苗供應耗盡。病情穩定或部分緩解的患者重復先前的治療周期。尚未接受IL-2治療的疾病進展者開始接受IL-2治療,而已經接受IL-2治療的疾病進展者退出研究。60例可評估患者中,2例完全緩解(CR),2例部分緩解(PR)。7例病情穩定,33例病情進展。16例患者未證實病情穩定,2例僅接種疫苗進展的患者在加入IL-2后病情穩定。這項研究發現HSPPC-96疫苗與免疫調節劑聯合使用可提高療效[12]。
參考文獻:
[1]Mazzaferro V, Coppa J, Carrabba MG, Rivoltini L, Schiavo M, Regalia E, Mariani L, Camerini T, Marchianò A, Andreola S, Camerini R, Corsi M, Lewis JJ, Srivastava PK, Parmiani G. Vaccination with autologous tumor-derived heat-shock protein gp96 after liver resection for metastatic colorectal cancer. Clin Cancer Res. 2003 Aug 15;9(9):3235-45. PMID: 12960108.
[2]Parmiani G, De Filippo A, Pilla L, Castelli C, Rivoltini L. Heat shock proteins gp96 as immunogens in cancer patients. Int J Hyperthermia. 2006 May;22(3):223-7. doi: 10.1080/02656730600647957. PMID: 16754342.
[3]Pilla L, Squarcina P, Coppa J, Mazzaferro V, Huber V, Pende D, Maccalli C, Sovena G, Mariani L, Castelli C, Parmiani G, Rivoltini L. Natural killer and NK-Like T-cell activation in colorectal carcinoma patients treated with autologous tumor-derived heat shock protein 96. Cancer Res. 2005 May 1;65(9):3942-9. doi: 10.1158/0008-5472.CAN-04-3493. PMID: 15867395.
[4]Eton O, Ross MI, East MJ, Mansfield PF, Papadopoulos N, Ellerhorst JA, Bedikian AY, Lee JE. Autologous tumor-derived heat-shock protein peptide complex-96 (HSPPC-96) in patients with metastatic melanoma. J Transl Med. 2010 Jan 29;8:9. doi: 10.1186/1479-5876-8-9. PMID: 20109236; PMCID: PMC2835652.
[5]Testori A, Richards J, Whitman E, Mann GB, Lutzky J, Camacho L, Parmiani G, Tosti G, Kirkwood JM, Hoos A, Yuh L, Gupta R, Srivastava PK; C-100-21 Study Group. Phase III comparison of vitespen, an autologous tumor-derived heat shock protein gp96 peptide complex vaccine, with physician’s choice of treatment for stage IV melanoma: the C-100-21 Study Group. J Clin Oncol. 2008 Feb 20;26(6):955-62. doi: 10.1200/JCO.2007.11.9941. Erratum in: J Clin Oncol. 2008 Aug 1;26(22): 3819. PMID: 18281670.
[6]Maki RG, Livingston PO, Lewis JJ, Janetzki S, Klimstra D, Desantis D, Srivastava PK, Brennan MF. A phase I pilot study of autologous heat shock protein vaccine HSPPC-96 in patients with resected pancreatic adenocarcinoma. Dig Dis Sci. 2007 Aug;52(8):1964-72. doi: 10.1007/s10620-006-9205-2. Epub 2007 Apr 10. PMID: 17420942.
[7]Younes A. A phase II study of heat shock protein-peptide complex-96 vaccine therapy in patients with indolent non-Hodgkin’s lymphoma. Clin Lymphoma. 2003 Dec;4(3):183-5. doi: 10.3816/clm.2003.n.029. PMID: 14715102.
[8]Bloch O, Crane CA, Fuks Y, Kaur R, Aghi MK, Berger MS, Butowski NA, Chang SM, Clarke JL, McDermott MW, Prados MD, Sloan AE, Bruce JN, Parsa AT. Heat-shock protein peptide complex-96 vaccination for recurrent glioblastoma: a phase II, single-arm trial. Neuro Oncol. 2014 Jan;16(2):274-9. doi: 10.1093/neuonc/not203. Epub 2013 Dec 12. PMID: 24335700; PMCID: PMC3895386.
[9]Crane CA, Han SJ, Ahn B, Oehlke J, Kivett V, Fedoroff A, Butowski N, Chang SM, Clarke J, Berger MS, McDermott MW, Prados MD, Parsa AT. Individual patient-specific immunity against high-grade glioma after vaccination with autologous tumor derived peptides bound to the 96 KD chaperone protein. Clin Cancer Res. 2013 Jan 1;19(1):205-14. doi: 10.1158/1078-0432.CCR-11-3358. Epub 2012 Aug 7. PMID: 22872572.
[10]Ji N, Zhang Y, Liu Y, Xie J, Wang Y, Hao S, Gao Z. Heat shock protein peptide complex-96 vaccination for newly diagnosed glioblastoma: a phase I, single-arm trial. JCI Insight. 2018 May 17;3(10):e99145. doi: 10.1172/jci.insight.99145. PMID: 29769450; PMCID: PMC6012501.
[11]Cohen L, de Moor C, Parker PA, Amato RJ. Quality of life in patients with metastatic renal cell carcinoma participating in a phase I trial of an autologous tumor-derived vaccine. Urol Oncol. 2002 May-Jun;7(3):119-24. doi: 10.1016/s1078-1439(01)00182-x. PMID: 12474545.
[12]Jonasch E, Wood C, Tamboli P, Pagliaro LC, Tu SM, Kim J, Srivastava P, Perez C, Isakov L, Tannir N. Vaccination of metastatic renal cell carcinoma patients with autologous tumour-derived vitespen vaccine: clinical findings. Br J Cancer. 2008 Apr 22;98(8):1336-41. doi: 10.1038/sj.bjc.6604266. Epub 2008 Mar 25. PMID: 18362942; PMCID: PMC2361701.
編輯:小果果,轉載請注明出處:http://www.448371.com/linchuang/lcyj/22791.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃