嚴重急性呼吸綜合征冠狀病毒 2 (SARS-CoV-2) 導致 2019 年冠狀病毒病 (Covid-19) 持續大流行。治療患有嚴重疾病階段的患者需要有效的療法。
間充質干細胞 (MSCs) 已在眾多臨床試驗中進行了評估,但存在特殊運輸儲存條件等挑戰等。MSCs 的大多數獨特特性與其旁分泌活性有關,尤其是與它們的外泌體有關。
幾項研究已經證明了 MSCs 衍生的外泌體 (MSC-Es) 對 Covid-19 并發癥的影響。MSC-Es 可能會改善 Covid-19 的一些并發癥,例如細胞因子風暴、急性呼吸窘迫綜合征 (ARDS) 和急性肺損傷 (ALI)。
此外,這些外泌體可以作為一種適用于抗病毒治療劑的納米級載體進行評估。在此,作者介紹了MSCs 及其衍生的外泌體在治療 Covid-19 中的幾種潛在應用。
本文作者Maryam Yousefi Dehbidi等來自伊朗德黑蘭卡拉茲米大學生物科學學院細胞與分子科學系,原標題Mesenchymal stem cells and their derived exosomes to combat Covid–19,編譯如下:
?
Covid-19 是由嚴重急性呼吸系統綜合癥冠狀病毒 2 (SARS-CoV-2) 引起的,于 2019 年 12 月在中國武漢首次報道,并迅速在全球蔓延。1由于這種病毒性疾病的高度和迅速傳播,世界衛生組織 (WHO) 于 2020 年 3 月 11 日宣布此次疫情為大流行。
?
根據Worldometer實時統計數據,截至北京時間2022年3月2日6時30分,全球累計確診新冠肺炎病例438295585例,累計死亡病例5981319例。全球單日新增確診病例1518357例,新增死亡病例8620例。
?
病毒基因編碼 16 種非結構蛋白 (NSP1 -16)、4種結構蛋白(刺突蛋白 (S)、包膜蛋白 (E)、核衣殼蛋白 (N) 和膜蛋白 (M))以及大約九種輔助蛋白。基于人群的疫苗接種策略代表了我們目前針對這種冠狀病毒。隨著突變的發生及其顯著抑制疫苗效力的潛在能力,開發互補的抗 Covid-19 策略仍然是全球優先事項。
干細胞及其衍生的外泌體已被證明是修復、再生、并以最小的副作用保護人體器官免受各種身體傷害。
?
干細胞分泌組 (SCS) 已被證明具有顯著的抗纖維化、抗炎、免疫調節和血管生成生物活性。外泌體是直徑為 40-150 nm 的納米級細胞外囊泡,由細胞產生它們的內部,更準確地說是在大多數真核細胞的內體隔室中。MSC 產生的外泌體具有顯著的組織恢復免疫調節能力。MSC-ES 的這些特性已被認為是當前正在進行的臨床試驗的基礎。這些 MSC-ES中的許多含有調節關鍵細胞功能的 microRNA (miRNA),包括細胞生長、凋亡和宿主免疫反應。?因此有人提出,MSC-ES代表了一種理想的載體,用于遞送靶向抗病毒藥物以治療 Covid-19。
?
干細胞療法
?
近年來,間充質干細胞及其治療潛力備受關注。間充質干細胞是非特化的、多能細胞、可自我更新的細胞,并且能夠分化成特定的細胞類型。間充質干細胞是一種易于獲取的細胞,其來源廣泛,包括骨髓、脂肪組織、肺、臍帶組織、牙髓、胎盤、沃頓膠、胎肝和經血。MSC通過與宿主免疫細胞的直接相互作用或通過分泌旁分泌細胞因子間接調節免疫系統。它們的旁分泌活性是通過分泌稱為分泌組的分子來進行的,其中包括轉錄因子、生長因子、細胞因子、趨化因子、激素、細胞外囊泡(例如外泌體)、血管生成分子、核酸和脂質介質,它們的生物學功能和特性如遷移、血管生成、歸巢、代謝調節、抗炎、抗纖維化和抗細胞凋亡有助于組織再生和改善終末器官功能。
?
間充質干細胞的治療作用
?
間充質干細胞療法通過與免疫細胞(包括 B 和 T 細胞、樹突狀細胞 (DCs)、巨噬細胞、中性粒細胞和自然殺傷細胞 (NK))相互作用而具有潛在的免疫調節特性,因此引起了人們的關注。
?
例如,宿主體內的炎癥因子會改變 MSCs 的特性以調節免疫系統。肺部炎癥介質的釋放受 MSCs 上呈現的損傷相關分子模式 (DAMP) 的差異激活調節表面。Toll 樣受體 (TLRs) 被病毒 RNA (TLR3) 和病毒未甲基化 CpG-DNA (TLR9) 激活,導致大量細胞信號通路和 MSCs 激活。?
?
MSCs 可以通過下調抗-前列腺素 E2 (PGE-2) 和程序性死亡配體 1 (PD-L1) 等炎癥因子。它們的旁分泌活性可以通過直接轉移肺泡巨噬細胞的功能性線粒體和轉換炎癥表型 (M1) 來恢復肺泡巨噬細胞的代謝能力抗炎 (M2)。
它們還通過釋放抗氧化酶來對抗與肺部炎癥相關的氧化應激,例如:過氧化氫酶、超氧化物歧化酶和谷胱甘肽過氧化物酶。MSCs 治療已顯示出對病毒誘導的促炎細胞因子的顯著抑制。
?
MSCs 的免疫系統穩態和免疫抑制活性取決于:
(1)調節代謝;?
(2) CD73的表達,一種具有外核苷酸酶特性的ATP酶,參與細胞增殖;
(3) 將成熟的樹突狀細胞 (DC) 誘導為新的 Jagged-2 依賴性調節 DC;
(4) 調節免疫細胞功能。?
?
此外,MSCs 通過表達干擾素刺激的基因如干擾素誘導的跨膜家族 (IFITM)、精胺 N1-乙酰轉移酶 1(SAT1) 和干擾素 α 誘導蛋白 6 (IFI6)。
?
間充質干細胞通過增加 IL-10 和血管內皮生長因子 (VEGF) 的表達來修復和再生受損的肺組織,這對作為炎癥性疾病的 ARDS 患者有益。間充質干細胞還具有治療作用其他器官。它們可以減少腦炎并恢復大腦中的血腦屏障 (BBB)。在腸道中,它們可以調節炎癥、重塑組織并促進根除感染。
?
間充質干細胞臨床試驗
?
由于先前在治療血液、心臟、腎臟和肺部疾病(如 ARDS 和纖維化)方面的臨床結果,MSC 已用于 Covid-19 治療。1此外,先前在免疫介導治療方面的研究取得了成功的結果系統性紅斑狼瘡 (SLE)、移植物抗宿主病 (GVHD) 和病毒感染(例如 H5N1 和 H7N9)等炎癥性疾病為抗擊 COVID-19.57-61 提供了希望。
?
對于 Covid-19 患者的治療,建議所需劑量為 1-10 × 10E6 MSCs/kg 體重,平均 3 次加強劑量,確切劑量可能因患者的免疫系統和臨床癥狀而異。在一項臨床試驗,觀察到外周淋巴細胞和 IL-10 的數量增加,而免疫細胞過度分泌的細胞因子顯著減少,治療后癥狀改善,無副作用。?
?
病例研究使用人臍帶間充質干細胞 (HUCMSCs) 旨在評估高劑量產前 MSCs 的安全性、可行性和耐受性。這項研究表明,注射高劑量的 MSCs 對 ARDS 患者有益,而不會發生嚴重的不良事件。觀察到炎癥生物標志物(即 IL-8、TNF-α 和 C 反應蛋白)顯著減少,抗炎細胞因子(包括 IL-4 和 IL-10)水平顯著增加。
?
表 1 代表臨床用干細胞進行的試驗用于治療 Covid-19 患者。

間充質干細胞衍生的外泌體 (MSC-E) 對抗新冠病毒?Covid-19?
?
盡管細胞療法提供了許多優勢,但仍然存在四個主要挑戰;(1) 移植的 MSCs 由于對惡劣的環境條件(例如炎癥)高度敏感,影響在體內的存活率低;(2) 細胞通過時有阻塞小直徑肺動脈的風險;(3) 在 -80°C 的溫度下儲存的特殊要求。為了應對這些挑戰,外泌體治療是一種很有前景的策略,因為它具有較低的致瘤性、無繼發感染傳播、易于操作、簡單的儲存要求和可用性。
在多細胞生物中,大多數生理過程是通過細胞內信號傳導發生的。細胞外囊泡 (EV) 是脂質雙層囊泡,已被確定為信號細胞器,因為它們通過充當不同生物分子(包括 RNA、 EV 根據其生物發生和大小分為三組。(1) 外泌體;由多泡體與細胞膜融合分泌的小尺寸 EV(直徑 40-150 nm);(2) 微泡;細胞膜直接出芽釋放的中等大小的 EV(直徑 150-1000 nm),以及(3)凋亡小體;在程序性細胞死亡 – 凋亡過程中產生的隨機大小的 EV(直徑 50-2000 nm)。
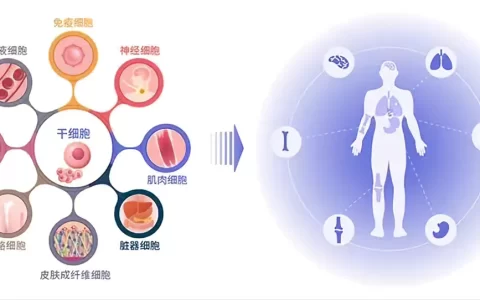
許多類型的細胞,包括免疫細胞和 MSCs 都會釋放外泌體。盡管大多數外泌體無論其細胞來源如何都具有進化上保守的蛋白質組成,但每個外泌體都包含一些依賴于其來源的組織特異性蛋白質(下圖1)。MSC-Es 蛋白質組包含大約 2000 種蛋白質,它們可以被分為兩類。一、膜蛋白;例如 GPI 錨定蛋白和四跨膜蛋白;第二,包裹在囊泡內的可溶性蛋白質;例如熱休克蛋白、伴侶蛋白、信號蛋白、細胞因子和白介素。除了蛋白質之外,mRNA 和 microRNA 是外泌體中存在的其他生物活性分子。
根據細胞微環境壓力和條件的來源,外泌體的組成可能非常多樣化。已經確定外泌體含有與分泌它們的細胞相似的貨物組成,這表明 MSC-E 在功能上與 MSC 的功能一致,72 而它們具有更多與 MSC 相比,MSC-E 具有穿透血屏障、較低免疫原性、無腫瘤發生風險、大規模生產和成本更低等優點,所有這些都使 MSC-E 成為治療 Covid-19 感染的潛在有前途的治療方法。

圖1:MSC-E 的貨物成分與其他外泌體高度相似,由蛋白質、mRNA 和 miRNA 組成。此外,MSC-Es 能夠傳遞其他治療劑以實現聯合治療策略。
間充質干細胞衍生的外泌體對新冠病毒的固有治療作用
?
間充質干細胞衍生的外泌體(MSC-E)的治療特性分為抗炎、免疫調節和組織再生作用,共同抑制細胞因子風暴并減少包括 ARDS、ALI 和纖維化在內的組織損傷狀況。MSC-Es 通過增加抗炎細胞因子的分泌和減少外周血單個核細胞 (PBMC) 中的促炎因子來調節免疫微環境。
在存在 MSC-E 的情況下,促炎細胞因子(如 IL-1β、TNF-α 和 IL-17)顯著減少,而抗炎細胞因子(如 TGF-β 和 IL-10)則顯著減少。MSC-Es 治療可減少 CD4+ T 細胞的增殖和凋亡,但增加調節性 T 細胞與效應 T 細胞的比例。這些在肺泡免疫微環境中的活動可以抑制感染引起的細胞因子風暴。
最近,許多研究都集中在 LPS(脂多糖)誘導的 ARDS 和 ALI 的動物模型上,以了解 MSC-E 在逆轉已建立的纖維化、ARDS 和 ALI 中的機制。以前的 ALI 細胞模型表明 MSC- Es 可以通過下調核因子紅細胞 2 相關因子 2 (NrF-2) 和抗氧化反應元件 (ARE) 因子來逆轉 ALI。MSC-Es 還可以顯著上調導致治療 ALI 的 NF-κB 信號通路。
盡管 MSC-E 的作用機制尚未完全了解,但這些結果被認為與外泌體 miRNA 貨物有關。miRNA 是小 RNA 的一個亞類,可以抑制翻譯過程,導致 mRNA 脫帽和去腺苷酸化。In-計算機分析顯示 MSC-E 中存在大量各種 miRNA 貨物,其中包括 258 個與細胞因子和趨化因子相關的 miRNA,以及 266 個與細胞死亡(焦亡、凋亡和壞死)基因相關的 miRNA。中國的研究人員已經證明了Ikbkb 基因導致 IKKβ 基因表達顯著下降,導致泛素特異性肽酶 (Usp) 5 下調,這是一種阻斷 IKKβ 泛素化的去泛素酶。正在進行的臨床試驗數量有限,以評估安全性和有效性MSC-E 用于治療 Covid-19,盡管在臨床前研究中取得了可喜的結果。
Covid-19 已在全球范圍內達到流行病的程度,影響到世界各地。迄今為止,尚無特定的抗病毒藥物可用于控制 SARS-CoV-2 感染患者。由于大多數國家在快速疫苗接種方面效率低下和大量病例,因此開發新的治療策略已成為解決這一緊迫臨床需求的大量研究工作的重點。MSCs 及其衍生的外泌體在 Covid-19 治療的研究中引起了廣泛關注,因為它們具有再生、免疫調節和抗炎等有前景的特性。先前的研究在臨床前研究中顯示出前景,現在正在各種臨床試驗中進行研究。MSC-E 在治療 Covid-19 和其他炎癥和組織損傷疾病方面顯示出顯著影響。MSC-Es 已被建議作為藥物遞送和聯合治療的有希望的候選者,因為它們能夠封裝各種治療劑、它們的納米尺寸和低免疫原性。然而,需要對 MSCs 與 MSCs-Es 的生物分布和體內代謝命運進行更多研究。目前從實驗室到臨床實踐的挑戰包括MSCs-Es的每個制造規模制劑的質量控制、生物分布和穩定性,這些都應該在未來進行研究。
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/gxb/9825.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃