健康狀態下,人體免疫系統處于一種穩態,既能識別和殺傷外來細胞或者變異的細胞,又能制約這種殺傷力,避免殺傷太過而殃及健康的組織細胞。人體中又廣泛存在具有免疫調節功能的間充質干細胞(MSC),那么免疫系統和MSC必然存在糾纏不清的或者互利互惠的相互作用方式。
大部分的關注度在于MSC對免疫系統的影響,較少的研究側重于免疫系統對MSC的作用。不少的研究者都已經明確了MSC不同于傳統的化學藥物和生物制劑,但是受到其他種類的干細胞的深刻影響,至今為止依然認為MSC是通過分化為身體組織的不同類型的細胞來發揮治療作用。
因此,本文從免疫細胞對MSC的作用這個角度出發,闡述MSC進入體內的歸宿,解釋了為何MSC并不是通過分化來發揮治療作用,即使MSC具有體內分化的能力。
首先,MSC具有體內分化的能力。妊娠早期,羊胎兒的免疫系統尚未得到建立,將人骨髓MSC注射到胎羊體內,可以觀察到人MSC在多個組織中存活長達13個月,而且觀察到MSC能分化為軟骨細胞、脂肪細胞、心肌細胞和心肌細胞、骨髓基質細胞和胸腺基質細胞[1]。但是13個月后就檢測不到人MSC的存在,說明人MSC進入羊體內,依然被羊的免疫細胞所清除[1]。
其次,需要大家認識到的是,由于MSC具有一定的免疫原性,所以不管是靜脈注射還是局部注射的MSC,都避免不了遲早被機體免疫細胞清除的命運,所以需要多次反復注射才能獲得較好的療效。當然,反復注射MSC也會引發另外一個問題,從而會影響到療效,本文也隨后給與講解。
o1
免疫細胞對MSC的清除
在多種動物物種中已經觀察到異基因MSC沒法長期定植,包括鼠[2, 3],狒狒[4],豬[5]和恒河猴[6]。不同動物模型都觀察到了4周或更長時間的異體MSC的存活[2, 4, 7]。然而,其他研究表明,與自體MSC相比,異體MSC輸入人體后的存活率降低了[8, 9]。盡管MSC的存活時間相對較長(長達24天),但在大鼠接受異體MSC顱內注射的部位,中性粒細胞、單核細胞和T細胞數量增加[2, 9]。
在大鼠異位骨形成模型中,種植在陶瓷支架上的異體MSC在皮下植入后迅速被破壞,并在這些植入物中可以發現淋巴細胞浸潤,這表明了宿主的免疫反應[10]。有趣的是,聯合使用短療程的他克莫司,MSC可以在支架中形成成骨分化細胞[10]。也有相反的研究結果,與對照組相比,異體MSC處理的皮膚傷口內中性粒細胞、單核細胞和T細胞數量減少,這提示異體MSC的抗炎作用優于局部注射細胞觸發的局部免疫反應[7]。
2012年卡羅琳斯卡大學醫院的團隊對接受MHC不匹配或單倍體相合MSC的18例患者的組織進行了尸檢組織分析,沒有觀察到異位組織形成(即沒有分化);只有一名患者(嚴重的免疫功能減退)在去世前7天接受了MSC輸注后在多個組織中顯示高水平的供體DNA(>1/1000個細胞)[11]。
2020年美國Wisconsin–Madison大學醫學院的一個團隊開展腸炎小鼠模型的治療研究發現,不僅熱滅活的MSC失去了所有的治療作用,而且剛解凍的MSC治療效果也有較大程度的下降(與PBS對照組沒有差異)[12]。
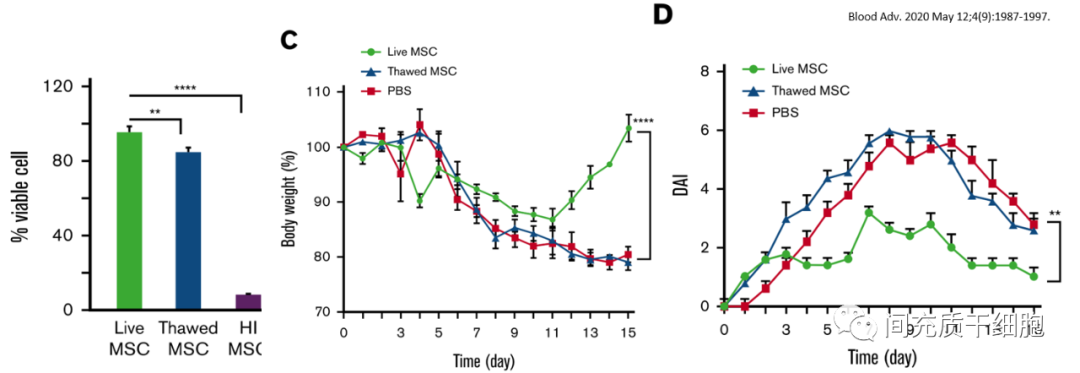
但是,這個研究的數據提示靜脈注射MSC卻不能有效治療腸炎,有效的治療方式是腹腔注射和皮下注射MSC[12]。腹腔注射的MSC可以快速遷移到腸炎部位,但是皮下注射卻優于靜脈注射,這個就比較費解了。因為皮下注射需要經過血液循環才能快速遷移到腸炎部位,也就是說皮下注射的MSC不僅需要面臨皮下組織的巨噬細胞的吞噬,還要面臨血液里面的免疫細胞對MSC的清除。這個結果和之前的很多研究結果相反,有效性研究是容易重復出來的,相反的結果只能說明其中一方的數據有問題。
o2
反復注射MSC產生抗體
加速清除MSC
在獼猴顱內植入異體骨髓MSC后,出現循環中的白細胞、淋巴細胞和中性粒細胞的短暫但顯著的增加,并在獼猴體內檢測到循環中的同種抗體,但發現受體血清與補體介導的溶解無關[6, 36]。不僅是獼猴,在注射MHC不匹配的MSC的小鼠、大鼠、豬和馬中也檢測到同種抗體[3, 5, 53, 59, 60]。未經處理和IFN-γ預處理的異體MSC,都能刺激健康大鼠注射異體MSC后產生供者特異性抗體[3]。
靜脈注射同種異體MSC可導致同種異體抗體的形成,這種抗體能夠促進補體介導的針對MSC的溶解,伴隨產生較低水平的IgM分泌[61]。接種了不匹配的異體MSC的小鼠在第二次輸注的24小時內表現出對供者來源的脾細胞的快速排斥反應[54]。接受異體MSC腹腔注射的小鼠產生了高滴度的同種異體反應抗體,并排斥了隨后的同種異體皮膚移植[53]。
但是,需要明確的是,并不是所有的注射MSC的個體都能產生相對于的抗體。給馬皮內注射MHC不匹配的MSC,約37%的馬會產生細胞毒性的抗MHC I同種抗體[59, 60]。Mesoblast公司的骨髓MSC產品用于心衰竭的局部注射治療,11%的患者體內檢測到針對異體骨髓MSC的HLA-I類抗原的抗體,只有1名患者檢測到骨髓MSC的HLA-II類抗原的抗體[62]。同樣是心衰患者,10名患者中有4位接受異體脂肪局部注射治療后,能檢測到異體脂肪MSC的HLA-I類抗原的抗體[63]。最近兩項人MSC臨床試驗監測患者同種異體抗體的產生,發現雖然大多數患者在注射同種異體骨髓MSC后沒有產生顯著的同種異體抗體,但少數患者確實產生了同種異體抗體[64, 65]。

有趣的是,在豬的心肌梗死模型中,MSC誘導的同種抗體的產生可以通過聯合應用免疫抑制劑鈣調神經磷酸酶抑制劑他克莫司來預防[61]。聯合使用異體MSC輸注和小劑量西羅莫司(雷帕霉素)治療可以使MHC完全不相合的小鼠心臟移植獲得長期存活[66]。
將C57BL/6小鼠來源的表達EPO的MSC(EPO-MSC)接種于膠原支架內,皮下注射同遺傳背景基因宿主(C57BL/6)或異基因宿主(BALB/c)宿主;作為MSC存活的指標,接受同基因EPO-MSC的小鼠的紅細胞壓積持續增加,而接受同種異基因EPO-MSC的小鼠的紅細胞壓積出現峰值,隨后恢復到基線水平;而且植入15天后取出的膠原支架分析顯示,CD8+T細胞和自然殺傷(NK)細胞僅在同種異體EPO-MSC移植物中有明顯的浸潤,并出現了針對EPO轉基因MSC的抗體,加速了異基因EPO-MSC的清除(紅細胞壓積的峰值降低)[9]。在另一項單獨的研究中,將異基因EPO-MSC注射到具有免疫活性的宿主中,導致了對EPO抗原的增敏和抗EPO免疫反應[67]。所以,不建議多次應用經過基因編輯的MSC,機體的免疫系統會識別到所編輯的基因,從而產生免疫應答反應,加速了MSC的清除。
馬骨髓或脂肪組織來源的MSC通過靜脈、動脈、腱內或眼內途徑注射,89%的馬在注射MSC后抗牛血清白蛋白(BSA)抗體呈陽性,但是抗BSA抗體的量與抗MSC抗體的產生沒有相關性[68]。此外,MSC的細胞表面可以結合補體[69],盡管補體對MSC功能的影響目前仍有爭議,補體介導的MSC的裂解很可能依賴于同種抗體[70]。
目前有許多標準的免疫學檢測方法和技術可用于檢測MSC的免疫原性。應該確定MHC單倍型,以了解供者或刺激者MSC與接受者或應答者細胞是完全不匹配還是部分不匹配。MSC的免疫調節功能可以用傳統的MLR來衡量,即反應和刺激脾細胞或PBL與MSC共培養,但同種異體MSC抑制T細胞增殖的能力與同種異體MSC的體內免疫原性無關。單抗原珠(SAB)分析、ELISPOTS和HLA四聚體也被用于篩選人類血清中MHC特異性同種抗體[71],商業試劑盒也很容易買到。然而,這些檢測并不能確定同種異體抗體的功能。
o3 小結
綜上所述,MSC不能被認為是真正的免疫豁免特權。MSC排斥的時間和嚴重程度依賴于MSC表達免疫原性和免疫系統之間的平衡決定。
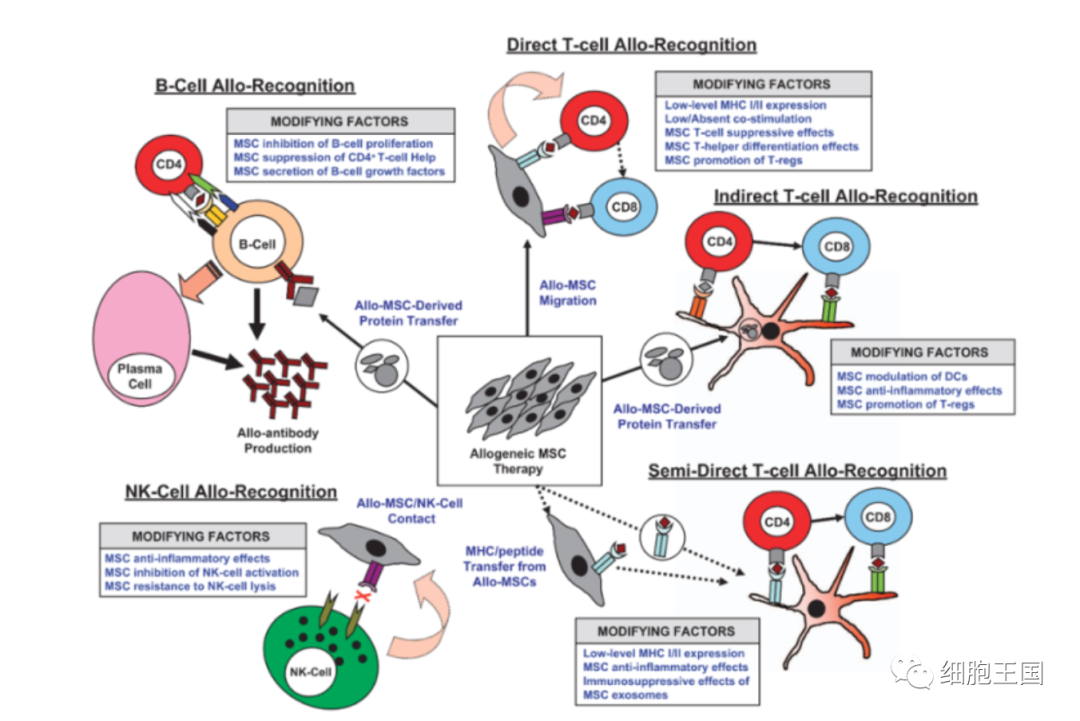
盡管如此,但是使用同基因(或自體)和異基因MSC的臨床前模型和臨床試驗并未顯示出與異基因MSC相關的不良事件。來自檢測同基因和異基因MSC在傷口修復小鼠模型的數據表明,同基因和異基因MSC不會像同種異體成纖維細胞那樣引起免疫反應[7]。使用骨髓MSC治療急性類固醇抗藥性GVHD的2期臨床試驗的數據也表明,使用同種異體骨髓MSC不會觸發免疫反應[72]。甚至凋亡的MSC亦能降低盲腸穿孔導致肺和腎損傷大鼠的死亡率、血液中的TNF-α水平以及循環和脾臟T輔助細胞和細胞毒性T細胞(CTL)水平均顯著降低[73, 74]。
自體MSC與異體MSC的療效是否對等?這個問題牽涉到的影響因素太多了,包括供體的年齡和健康狀態和MSC的培養體系等等。還需要注意一個關鍵的問題是,不同個體來源的MSC本身固有的免疫調節特性是否足以克服同種異體細胞所產生的免疫應答和免疫記憶過程。
傳統觀點認為,通過延長MSC注射后的持續期可以增強MSC治療的益處。但是,延長MSC的存活或提高MSC的免疫耐受性可以提高MSC的治療效果,這一點尚未在臨床上得到證明。即,延長MSC在體內的存活時間將轉化為持續的治療效果和改善臨床結果的假設,還有待臨床實踐的檢驗。
總體而言,目前認為MSC具有在體內啟動細胞免疫和體液免疫反應的能力,但由于固有的抗炎和免疫調節特性,與其他同種異體細胞相比,免疫原性的影響可能會大大減弱,從而整體上顯示出了良好的治療效果。這一點,在大量的臨床應用研究的文獻中得到了很好的證明,展示出MSC良好的治療效果。
正是由于MSC具有在體內啟動細胞免疫和體液免疫反應的能力,那么在臨床應用治療方案的確定上,應該把MSC的這個免疫原性考慮進入,采取一定的措施來盡可能降低MSC的免疫原性對治療效果的影響。
一句話總結MSC進入體內的命運:MSC在不斷發揮治療作用的同時,自己也被機體免疫細胞所識別和清除。
所以,MSC注射并非一勞永逸,臨床研究需根據不同的適應癥,適量、多次注射,或能達到理想的療效。
MSC正如蠟燭:燃燒自己,照亮別人!
編輯:小果果,轉載請注明出處:http://www.448371.com/cells/gxb/15215.html
免責聲明:本站所轉載文章來源于其他平臺,主要目的在于分享行業相關知識,傳遞當前最新資訊。圖片、文章版權均屬于原作者所有,如有侵權,請及時告知,我們會在24小時內刪除相關信息。
說明:本站所發布的案例均摘錄于文獻,僅用于科普干細胞與再生醫學相關知識,不作為醫療建議。


 微信掃一掃
微信掃一掃  支付寶掃一掃
支付寶掃一掃